2022-2023學年江蘇省南京市江寧區高二(下)期末化學試卷
發布:2024/7/22 8:0:9
一、單項選擇題(本題共12小題,每小題3分,共42分.每小題只有一個選項最符合題目要求.)
-
1.化學與人類生活、科技發展密切相關,下列有關說法正確的是( )
A.生產華為5G芯片“巴龍5000”的主要核心材料是硅酸鹽 B.推廣使用聚碳酸酯可降解塑料,有利于保護環境減少白色污染 C.生產N95口罩的聚丙烯能使酸性高錳酸鉀溶液褪色 D.“中國天眼”用到的高性能材料碳化硅是一種新型的有機高分子材料 組卷:12引用:2難度:0.7 -
2.反應Cl2+Na2SO3+H2O=Na2SO4+2HCl可用于污水脫氯。下列說法正確的是( )
A.Cl2是極性分子 B.H2O分子的球棍模型: 
C.Na2SO3既含離子鍵又含共價鍵 D.HCl的電子式為: 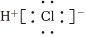 組卷:44引用:1難度:0.7
組卷:44引用:1難度:0.7 -
3.下列物質的性質與應用對應關系正確的是( )
A.聚合硫酸鐵能水解并形成膠體,可用于自來水的殺菌消毒 B.Na2O2具有強氧化性,可用作呼吸面具供氧劑 C.氧化鋁熔點很高,可用于制造耐火坩堝 D.SiO2硬度大,可用于制光導纖維 組卷:19引用:4難度:0.7 -
4.X、Y、Z、W為短周期中原子序數依次增大的四種主族元素。X和Z的基態原子的2p能級上各有兩個未成對電子,W與X同族。下列說法正確的是( )
A.原子半徑:r(W)>r(Y)>r(Z) B.簡單氫化物的沸點:X>W>Z C.元素第一電離能:I1(Z)>I1(Y)>I1(X) D.最高價氧化物對應水化物的酸性:W>X>Y 組卷:44引用:1難度:0.5 -
5.下列實驗操作能達到實驗目的的是( )
A B C D 
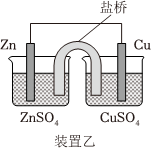

通過裝置甲除去乙烯中的少量SO2 通過裝置乙構成鋅銅原電池 通過操作丙蒸干MgCl2溶液制無水MgCl2固體 通過操作丁制備用于檢驗醛基的氫氧化銅懸濁液 A.A B.B C.C D.D 組卷:16引用:1難度:0.5
二、非選擇題(本題共4小題,共計58分.請將解答填寫在答題卡相應的位置.)
-
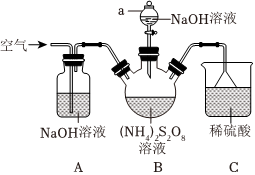 17.過硫酸鈉(Na2S2O8)常用作漂白劑、氧化劑等。某研究小組利用如圖所示裝置制備Na2S2O8并探究其性質(加熱及夾持儀器略去)。
17.過硫酸鈉(Na2S2O8)常用作漂白劑、氧化劑等。某研究小組利用如圖所示裝置制備Na2S2O8并探究其性質(加熱及夾持儀器略去)。
Ⅰ.制備Na2S2O8
已知:①(NH4)2S2O8+2NaOHNa2S2O8+2NH3↑+2H2O;55℃
②2NH3+3Na2S2O8+6NaOH6Na2SO4+N2+6H2O;90℃
③Na2S2O8是白色晶狀粉末,易溶于水,加熱至65℃就會發生分解。
(1)儀器a的名稱是。
(2)裝置B中發生反應的同時,需要持續通入空氣的目的是。
(3)反應完畢,將三頸圓底燒瓶中的溶液減壓蒸發、結晶過濾、洗滌干燥,可得過硫酸鈉,減壓蒸發的原因是。
Ⅱ.測定產品純度
(4)稱取0.3000g樣品于磺量瓶中,加入30mL水溶解,加入4.000gKI固體(略過量)搖勻,溶液中S2被還原為O2-8,在暗處放置30min,再加入適量醋酸溶液酸化,以淀粉溶液作指示劑,用0.1000mol?L-1Na2S2O3標準溶液滴定至終點(滴定反應為I2+2S2SO2-4=2I-+S4O2-3),共消耗Na2S2O3標準溶液20.00mL。計算Na2S2O8樣品的純度(寫出計算過程)O2-6。
Ⅲ.探究的性質
(5)Na2S2O8溶液與銅粉反應只生成兩種鹽且反應先慢后快,某同學推測反應先慢后快的原因可能是生成的Cu2+對反應起催化作用,設計實驗方案檢驗該推測是否正確。(實驗中供選擇試劑:Cu粉、Na2S2O8溶液、Na2SO4溶液、CuSO4,溶液、Cu(NO3)2溶液、CuCl2溶液)組卷:22引用:1難度:0.7 -
18.以錳渣(含MnO2及少量Pb、Fe、Cu元素的氧化物)和黃鐵礦(主要成分為FeS2)為原料可制備Mn3O4和MnCO3,過程可表示為:
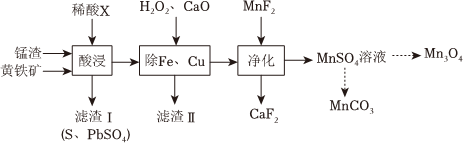
(1)酸浸:將錳渣與黃鐵礦粉碎混合,用稀酸X浸取.研究發現,酸浸時,FeS2和MnO2顆粒參與反應的原理如圖所示(部分產物未標出)。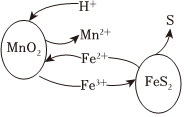
①所用的稀酸X是(填名稱)。
②FeS2和MnO2顆粒參與反應的過程可描述為。
③若黃鐵礦用量增加,錳的浸出率會降低,可能的原因是。
(2)除鐵銅:濾渣Ⅱ的主要成分為(填化學式)。
(3)MnSO4溶液和氨水-NH4HCO3混合溶液反應,生成MnCO3沉淀.反應的離子方程式為。
(4)產物Mn3O4中錳元素的化合價為。組卷:22引用:1難度:0.5


