2022-2023學年寧夏銀川六中高三(上)第二次月考化學試卷
發布:2025/1/3 3:0:2
一、單選題(共25小題,每小題2分,共50分)
-
1.我國古代科技富載化學知識。下列對古文獻涉及的化學知識敘述不正確的是( )
選項 古文 化學知識 A 燒酒法用濃酒和糟入甑,蒸令氣上,用器承滴露 燒酒釀制用了蒸餾的方法 B “石膽化鐵為銅”開創了人類文明史濕法冶金先河 利用金屬單質置換反應 C 南安有黃長者為宅煮糖,宅垣忽壞,去土而糖白 黃泥來吸附糖中的色素 D 丹砂燒之成水銀,積變又成丹砂 丹砂熔融成液態,冷卻變成晶體 A.A B.B C.C D.D 組卷:31引用:7難度:0.7 -
2.化學與人類生活、生產和社會可持續發展密切相關,下列說法不正確的是( )
A.有機磷農藥多為磷酸酯或硫代磷酸酯類物質,肥皂水等堿性物質有利其水解而解毒 B.使用國際通行的凱氏定氮法測定奶著中的蛋白質含量時,會把三聚氰胺當做蛋白質而導致測定結果偏高 C.石油催化裂化的主要目的是得到更多的乙烯、丙烯等氣態短鏈烴;石油裂解的主要目的是提高汽油等輕質油的產量 D.《天工開物》中有如下描述:“世間絲、麻、裘、褐皆具素質……”文中的“裘”主要成分是蛋白質 組卷:6引用:2難度:0.8 -
3.amolN2和O2的混合氣體與amol的NO比較,下列判斷錯誤的是( )
A.在同溫同壓下密度一定相等 B.在同溫同體積下壓強一定相等 C.在標準狀況下體積一定相等 D.在任何狀況下原子數一定相等 組卷:19引用:1難度:0.7 -
4.設NA為阿伏加德羅常數的值。以下表達正確的選項是( )
A.在標況下,11.2LNO與11.2LO2混合后所含分子數為0.75NA B.12g金剛石中含有的共價鍵數為4NA C.0.1molNa2O2晶體中含有0.3NA個離子 D.鋁跟氫氧化鈉溶液反應生成1mol氫氣時,轉移的電子數為NA 組卷:16引用:2難度:0.6 -
5.設NA為阿伏加德羅常數的值。下列說法正確的是( )
A.標準狀況下,2.24 LSO3中所含原子數為0.4NA B.10mL 12mol/L鹽酸與足量MnO2加熱反應,制得Cl2的分子數為0.03NA C.0.1molCH4與0.4mol Cl2在光照下充分反應,生成CCl4的分子數為0.1NA D.常溫常壓下,6g乙酸中含有C一H鍵的數目為0.3NA 組卷:45引用:3難度:0.8 -
6.室溫下,下列各組離子在指定溶液中能大量共存的是( )
A.NaOH溶液:Na+、K+、CO32-、Al3+ B.FeSO4溶液:H+、Mg2+、Cl-、NO3- C.KHCO3溶液:Na+、Cl-、SO42-、CO32- D.H2SO4溶液:K+、Ba2+、NO3-、CH3COO- 組卷:28引用:4難度:0.7 -
7.下列各組離子在指定溶液中一定能大量共存的有幾組( )
①酸性溶液中:Na+、ClO-、SO42-、I-
②無色溶液中:K+、Na+、MnO4-、SO42-
③堿性溶液中:Cl-、CO32-、SO42-、K+、AlO2-
④中性溶液中:Fe3+、K+、Cl-、SO42-
⑤常溫下,由水電離出的c(OH-)=1×10-13mol?L-1的溶液中:Na+、Ba2+、Cl-、Br-
⑥與鋁粉反應放出H2的無色溶液中:NO3-、Al3+、Na+、SO42-A.1組 B.2組 C.3組 D.4組 組卷:22引用:1難度:0.7 -
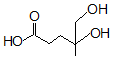 8.已知有機物是合成青蒿素的原料之一(如圖)。下列有關該有機物的說法正確的是( )
8.已知有機物是合成青蒿素的原料之一(如圖)。下列有關該有機物的說法正確的是( )A.可與酸性KMnO4溶液反應 B.既能發生消去反應,又能發生加成反應 C.分子式為C6H10O4 D.1mol該有機物與足量的金屬Na反應最多產生33.6LH2 組卷:50引用:3難度:0.7 -
9.中成藥連花清瘟膠囊對于治療輕型和普通型的新冠肺炎有確切的療效。其有效成分綠原酸及其水解產物M的結構簡式如圖,下列有關說法正確的是( )
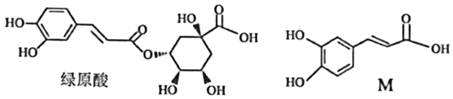
A.兩種分子中所有原子可能共平面 B.M的分子式為C9H10O4 C.綠原酸和M都能發生加成、取代和加聚反應 D.綠原酸和M最多都能與3molBr2發生反應 組卷:8引用:2難度:0.6
二、填空題(共4小題,共計50分)
-
28.鉻及其化合物有許多獨特的性質和用途。如煉鋼時加入一定量的鉻可得到不銹鋼,K2Cr2O7是實驗中常用的強氧化劑之一,從含有鉻、鋅、鋼、鐵、鎘(Cd)、鈷(Co)等單質的工業廢料回收鉻的生產流程如圖:
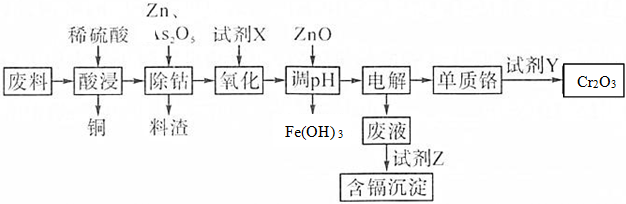
幾種金屬離子生成氫氧化物沉淀的pH見表:
請回答下列問題:氫氧化物 Fe(OH)3 Zn(OH)2 Cd(OH)2 Cr(OH)3 開始沉淀的pH 1.5 8 7.2 6 沉淀完全的pH 3.3 12 9.5 8
(1)寫出提高酸浸速率的措施(寫出兩點)。
(2)酸浸時形成的金屬離子的價態均相同,料渣中含有大量的CoAs合金,寫出除鈷時反應的離子方程式。
(3)若僅從試劑的經濟角度考慮,試劑X最好是,如果試劑X是H2O2,請寫出其氧化Fe2+的離子反應方程式。
(4)已知氧化過程中鐵、鉻形成的離子均被完全氧化,則調pH時應將pH控制在范圍內,單質鉻與試劑Y反應時,反應中二者消耗量n(Cr):n(Y)=。
(5)設計實驗檢驗廢液中是否含有Fe3+:。組卷:10引用:1難度:0.5 -
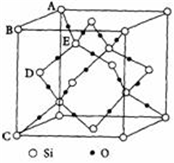 29.C和Si元素在化學中占有極其重要的地位。
29.C和Si元素在化學中占有極其重要的地位。
(1)寫出Si的基態原子核外最外層電子排布式,C、O、Si三種元素的電負性由大到小的順序為。
(2)干冰是分子晶體,其密度比冰大的原因是。SiC晶體的結構與晶體硅的相似,其中C原子的雜化方式為。
(3)氧化物XO的電子總數與SiC的相等,則X為(填元素符號),XO是優良的耐高溫材料,其熔點比CaO高的原因是。
(4)向盛有硫酸銅水溶液的試管中加氨水,先形成藍色沉淀,繼續加入氨水沉淀溶解,得到深藍色透明溶液。在這個過程中先生成藍色沉淀,后沉淀溶解的原因是:。
(5)如圖表示的是SiO2的晶胞結構(白圈代表硅原子,黑點代表氧原子),判斷在30g二氧化硅晶體中含molSi-O鍵。如果該立方體的邊長為acm,用NA表示阿伏加德羅常數,則SiO2晶體的密度表達式為g/cm3。組卷:10引用:1難度:0.5


