2016-2017學年江西省宜春市豐城中學尖子班高三(上)周練化學試卷(9.16)
發布:2024/4/20 14:35:0
一、選擇題(每小題4分,共48分)
-
1.化學與生活密切相關,下列說法不正確的是( )
A.在汽車排氣管上加裝“催化轉化器”可以減少有害氣體的排放 B.“84消毒液”具有強氧化性,可做環境的消毒劑從而預防流感 C.PM2.5是指大氣中直徑小于或等于2.5微米的顆粒物,也稱為“細顆粒物“,PM2.5在空氣中有可能形成膠體 D.碳酸鋇、碳酸氫鈉、氫氧化鋁均可作為抗胃酸藥物使用 組卷:12引用:1難度:0.8 -
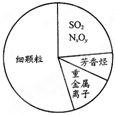 2.如圖為霧霾的主要成分示意圖.下列說法不正確的是( )
2.如圖為霧霾的主要成分示意圖.下列說法不正確的是( )A.重金屬離子可導致蛋白質變性 B.苯是最簡單的芳香烴 C.向空氣中大量排放SO2和NxOy都能引起酸雨和光化學煙霧 D.汽車尾氣的大量排放是造成霧霾天氣的人為因素之一 組卷:11引用:8難度:0.9 -
3.下列有關實驗操作、發生的現象、解釋或結論都正確的是( )
選項 實驗操作 實驗現象 解釋或結論 A 向AgCl沉淀中滴加KI溶液 沉淀變為黃色 Ksp(AgCl)>Ksp(AgI) B 將SO2通入滴有酚酞的
NaOH溶液中溶液紅色褪去 SO2具有漂白性 C 常溫下銅片插入濃硫酸中 無明顯現象 常溫下銅遇濃硫酸鈍化 D 向某溶液中加入過量鹽酸 產生能使澄清石灰水變渾濁的無色氣體 該溶液中一定含有 CO2-3A.A B.B C.C D.D 組卷:43引用:16難度:0.9 -
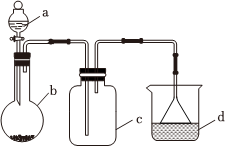 4.實驗室中某些氣體的制取、收集及尾氣處理裝置如圖所示(省略夾持和凈化裝置)。僅用此裝置和表中提供的物質完成相關實驗,最合理的選項是( )
4.實驗室中某些氣體的制取、收集及尾氣處理裝置如圖所示(省略夾持和凈化裝置)。僅用此裝置和表中提供的物質完成相關實驗,最合理的選項是( )選項 a中的物質 b中的物質 c中收集的氣體 d中的物質 A 濃氨水 CaO NH3 H2O B 濃硫酸 Na2SO3 SO2 NaOH溶液 C 濃硝酸 Cu NO2 H2O D 濃鹽酸 MnO2 Cl2 NaOH溶液 A.A B.B C.C D.D 組卷:476引用:135難度:0.9
二、填空題(每空4分,共52分)
-
13.NCl3可用于漂白,也可用于檸檬等水果的熏蒸處理。已知:NCl3熔點為-40℃,沸點為70℃,95℃以上易爆炸,有刺激性氣味,可與水反應。實驗室中可用氯氣和氨氣反應制取NCl3,反應方程式為4NH3+3Cl2═NCl3+3NH4Cl.某校化學興趣小組同學設計了如圖1所示的實驗裝置(NH4Cl的分解溫度為300℃左右)。
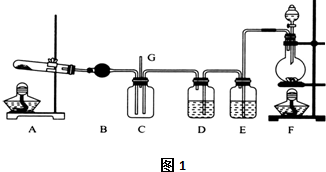
回答下列問題:
(1)寫出裝置F中的燒瓶內發生反應的離子方程式:。
(2)E中的試劑為。
(3)導管G末端應連接的裝置為圖2中的(填選項字母)。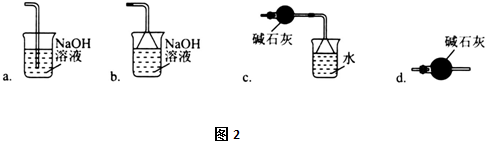
(4)NCl3遇水可發生水解反應生成兩種物質,其中一種是可使濕潤的紅色石蕊試紙變藍的氣體,寫出NCl3水解的化學方程式:。
(5)已知C中生成的NH4Cl溶解在NCl3中,欲將二者分離可采取的操作方法為。
(6)NH4Al(SO4)2也可用于自來水的凈化。
①NH4Al(SO4)2溶液中離子濃度由大到小的順序為。
②向NH4Al(SO4)2溶液中滴加氨水至溶液呈中性,在此過程中水的電離程度(填“增大”“減小”或“不變”)。
③常溫下,將a mol NH4Al(SO4)2:加入到b L c mol/L的氨水中,所得溶液呈中性,此時溶液中c(Al3+)≈0mol/L,計算該溫度下NH3?H2O的電離常數(用含字母的代數式表示,忽略溶液體積變化)。組卷:6引用:1難度:0.6 -
14.硫酸是用途廣泛的化工原料,可作脫水劑、吸水劑、氧化劑和催化劑等.
(1)用稀硫酸、銅和氧化鐵制取硫酸銅,生產的主要過程如下圖所示: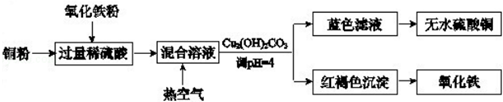
稀硫酸、銅和氧化鐵反應過程中屬于氧化還原反應的離子方程式是;向混合溶液中通入熱空氣的反應的離子方程式是;由濾液得到無水硫酸銅的實驗操作是.
(2)氨法脫硫技術可吸收硫酸工業尾氣中的二氧化硫,同時制得硫酸銨.主要的工藝流程如下圖所示: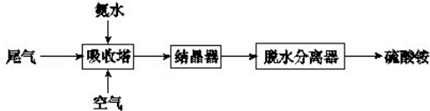
①吸收塔中發生反應的化學方程式是.
②有數據表明,吸收塔中溶液的pH在5.5-6.0之間,生產效率較高.當控制一定流量的尾氣時,調節溶液的pH的方法是.組卷:5引用:2難度:0.5


