魯科版(2019)必修第二冊《2.2.2 化學電池》2020年同步練習卷(1)
發布:2024/4/20 14:35:0
-
1.下列裝置中,都伴隨有能量變化,其中是由化學能轉變為電能的是( )
A. 
電解水B.  水力發電
水力發電C. 
太陽能熱水器D. 
干電池組卷:245引用:37難度:0.9 -
2.電化學裝置工作時,下列電極上發生的反應一定是氧化反應的是( )
A.陰極 B.負極 C.銅電極 D.石墨電極 組卷:101引用:10難度:0.9 -
3.下列化學反應能設計成原電池的是( )
A.CaCO3+2HCl═CaCl2+H2O+CO2↑ B.BaCl2+Na2SO4═2NaCl+BaSO4↓ C.2NaOH+CO2═Na2CO3+H2O D.Fe+CuCl2═FeCl2+Cu 組卷:44引用:3難度:0.8 -
4.若某裝置發生如下反應:Cu+2H+═Cu2++H2↑,關于該裝置的有關說法正確的是( )
A.該裝置一定為原電池 B.該裝置為電解池 C.若為原電池,Cu為正極 D.電解質溶液可能是硝酸溶液 組卷:18引用:1難度:0.7 -
5.人們通過堿性鋅錳干電池制成了“紙質電池”,采用一個薄層紙片(在其一邊鍍鋅,另一邊鍍MnO2),紙內的離子“流過”由氧化鋅和水組成的電解液,下列說法正確的是( )
A.電池負極反應式:Zn-2e-+2OH-═ZnO+H2O B.當電解液中有1.204×1023個電子經過時,溶解了0.1mol MnO2 C.氧化鋅起傳導電子的作用 D.該電池反應中MnO2起催化劑作用 組卷:90引用:3難度:0.8
-
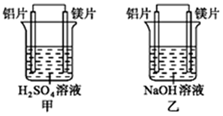 15.有甲、乙兩位同學均想利用原電池反應檢測金屬的活動性順序,兩人均使用鎂片與鋁片作電極,甲同學將電極放入6mol?L-1 H2SO4溶液中,乙同學將電極放入6mol?L-1的NaOH溶液中,如圖所示。
15.有甲、乙兩位同學均想利用原電池反應檢測金屬的活動性順序,兩人均使用鎂片與鋁片作電極,甲同學將電極放入6mol?L-1 H2SO4溶液中,乙同學將電極放入6mol?L-1的NaOH溶液中,如圖所示。
請回答:
(1)寫出甲池中正極的電極反應式:;負極的電極反應式:。
(2)乙池中負極是;正極是。
(3)由此實驗,可得到如下哪些正確結論?(填寫字母序號)。
a.利用原電池反應判斷金屬活動性順序時應注意選擇合適的介質
b.鎂的金屬性不一定比鋁的金屬性強
c.該實驗說明金屬活動性順序已過時,已沒有實用價值
d.該實驗說明化學研究對象復雜,反應受條件影響較大,應具體問題具體分析組卷:31引用:1難度:0.5 -
16.利用化學反應:2FeCl3+Cu═2FeCl2+CuCl2,請你選擇合適的電極材料和電解質溶液,設計一個原電池。可供選擇的電極材料:鐵棒、銅棒、石墨棒。可供選擇的電解質溶液:CuCl2溶液、FeCl2溶液、FeCl3溶液。請填寫下列空白:
(1)選擇作正極材料,作負極材料;選擇作電解質溶液。
(2)寫出有關的電極反應式:正極:;負極:。組卷:50引用:4難度:0.7


