2019-2020學年天津七中高三(上)期中化學試卷
發(fā)布:2024/12/28 2:30:2
一、選擇題(共18小題,每小題3分,滿分54分)
-
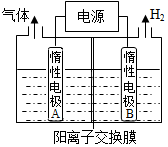 1.利用LiOH和鈷氧化物可制備鋰離子電池正極材料。可用電解LiCl溶液制備LiOH,裝置如圖所示。下列說法正確的是( )
1.利用LiOH和鈷氧化物可制備鋰離子電池正極材料。可用電解LiCl溶液制備LiOH,裝置如圖所示。下列說法正確的是( )A.電極B連接電源正極 B.A極區(qū)電解液為LiCl溶液 C.陽極反應式為:2H2O+2e-=H2↑+2OH- D.每生成1molH2,有1molLi+通過該離子交換膜 組卷:139引用:4難度:0.5 -
2.景泰藍是一種傳統(tǒng)的手工藝品.下列制作景泰藍的步驟中,不涉及化學變化的是( )
A B C D 將銅絲壓扁,掰成圖案 
將鉛丹、硼酸鹽等化合熔制后描繪 
高溫焙燒 
酸洗去污 
A.A B.B C.C D.D 組卷:120引用:16難度:0.9 -
3.甲溶液的pH是4,乙溶液的pH是5,甲溶液與乙溶液的c(H+)之比為( )
A.10:1 B.1:10 C.2:1 D.1:2 組卷:331引用:19難度:0.9 -
4.一定溫度下,在3個1.0 L的恒容密閉容器中分別進行反應2X(g)+Y(g)?Z(g)△H,達到平衡。相關數(shù)據(jù)如表。
下列說法不正確的是( )容器 溫度/K 物質(zhì)的起始濃度/mol?L-1 物質(zhì)的平衡濃度/mol?L-1 c(X) c(Y) c(Z) c(Z) Ⅰ 400 0.20 0.10 0 0.080 Ⅱ 400 0.40 0.20 0 a Ⅲ 500 0.20 0.10 0 0.025 A.平衡時,X的轉(zhuǎn)化率:Ⅱ>Ⅰ B.平衡常數(shù):K(Ⅱ)>K(Ⅰ) C.達到平衡所需時間:Ⅲ<Ⅰ D.反應的△H<0 組卷:18引用:4難度:0.5 -
5.聚乙烯胺可用于合成染料Y,增加纖維著色度,乙烯胺(CH2=CHNH2)不穩(wěn)定,所以聚乙烯胺常用聚合物X水解法制備。下列說法不正確的是( )

A.乙烯胺與CH3CH=NH互為同分異構(gòu)體 B.測定聚乙烯胺的平均相對分子質(zhì)量,可得其聚合度 C.聚合物X在酸性或堿性條件下發(fā)生水解反應后的產(chǎn)物相同 D.聚乙烯胺和R-N=C=S合成聚合物Y的反應類型是加成反應 組卷:21引用:5難度:0.7 -
6.25℃時,將10mL質(zhì)量分數(shù)為50%(密度1.4g/mL)的硫酸稀釋成100mL,下列說法正確的是( )
A.純硫酸的摩爾質(zhì)量為98 B.上述100mL稀硫酸中含溶質(zhì)14g C.上述稀釋過程所需要的蒸餾水為90mL D.質(zhì)量分數(shù)為50%的硫酸物質(zhì)的量濃度為7.14mol/L 組卷:161引用:4難度:0.5 -
7.研究生鐵的銹蝕,下列分析不正確的是( )
序號 ① ② ③ 實驗 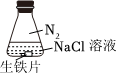
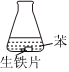
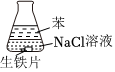
現(xiàn)象 8小時未觀察
到明顯銹蝕8小時未觀察
到明顯銹蝕1小時觀察
到明顯銹蝕A.①中,NaCl溶液中溶解的O2不足以使生鐵片明顯銹蝕 B.②中,生鐵片未明顯銹蝕的原因之一是缺少H2O C.③中正極反應:O2+4e-+2H2O═4OH- D.對比①②③,說明苯能隔絕O2 組卷:229引用:11難度:0.8
二、填空題(共46分)
-
20.(1)某學生用 0.10mol?L-1 的標準 NaOH 溶液滴定未知濃度的鹽酸,取 20.00mL 待測稀鹽酸溶液放入錐形瓶 中,并滴加 2~3 滴酚酞作指示劑。重復上述滴定操作 2~3 次。
在上述實驗中,下列操作(其他操作正確)會造成測定結(jié)果偏高的有。
A.滴定前平視讀數(shù),終點讀數(shù)時仰視讀數(shù)
B.錐形瓶水洗后未用待測鹽酸潤洗
C.酸式滴定管使用前,水洗后未用待測鹽酸溶液潤洗
D.標準液漏滴在錐形瓶外一滴
E.堿式滴定管尖嘴部分有氣泡,滴定后消失
(2)氧化還原滴定--葡萄酒中抗氧化劑殘留量的測定
葡萄酒常用 Na2S2O5 作抗氧化劑。測定某葡萄酒中抗氧化劑的殘留量(以游離 SO2 計算)的方案如下:
注:實驗中加入鹽酸的目的:將 Na2S2O5 全部轉(zhuǎn)化成 SO2。
①滴定時,I2 溶液應裝在(“酸”或“堿”)式滴定管中,滴定終點時滴定現(xiàn)象是。
②實驗消耗標準 I2 溶液 25.00mL,所測樣品中抗氧化劑的殘留量(以游離 SO2 計算)為g?L-1。
③上述滴定過程中的原理為(用離子方程式表示),下列情形會造成測定結(jié)果偏高的是。
A.滴定持續(xù)時間稍長,溶液中部分 HI 被空氣氧化
B.滴定前平視,滴定后俯視
C.盛裝標準 I2 溶液的滴定管用蒸餾水洗凈后,未潤洗
D.滴定前滴定管尖嘴有氣泡,滴定后氣泡消失
(3)沉淀滴定--滴定劑和被滴定物的生成物比滴定劑與指示劑的生成物更難溶。
參考下表中的數(shù)據(jù),若用 AgNO3 滴定 NaSCN 溶液,可選用的指示劑是(填選項字母)。
A.NaCl難溶物 AgCl AgBr AgCN Ag2CrO4 AgSCN 顏色 白 淺黃 白 磚紅 白 Ksp 1.77×10-10 5.35×10-13 1.21×10-16 1.12×10-12 1.0×10-12
B.NaBr
C.NaCN
D.Na2CrO4組卷:10引用:1難度:0.5 -
21.氮及其化合物的轉(zhuǎn)化對工農(nóng)業(yè)生產(chǎn)及環(huán)境保護有重要的意義。
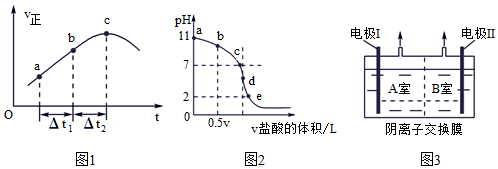
(1)下面是氮的氧化物在幾種不同情況下的轉(zhuǎn)化:
①已知:2SO2(g)+O2(g)?2SO3(g) ΔH=-196.6 kJ?mol-1
2NO(g)+O2(g)?2NO2(g) ΔH=-113.0 kJ?mol-1
則SO2氣體與NO2氣體反應生成SO3氣體和NO氣體的熱化學方程式為。
②a.向絕熱恒容密閉容器中通入SO2和NO2,一定條件下使其反應達到平衡,正反應速率隨時間變化的示意圖如圖1所示。反應在c點(填“達到”或“未到”)平衡狀態(tài)。
b.開始時,分別在該容器中加入Ⅰ:2 mol SO2(g)和2 mol NO2(g);Ⅱ:2 mol SO3(g)和2 mol NO(g)。則反應達到平衡時,平衡常數(shù):Ⅰ(填“>”“=”或“<”)Ⅱ。
(2)常溫時向濃度為0.1 mol?L-1體積為V L的氨水中逐滴加入一定濃度的鹽酸,用pH計測得溶液的pH隨鹽酸體積的變化曲線如圖2所示,d點處兩種溶液恰好完全反應。
根據(jù)圖2回答下列問題:
①b、c、d三點對應的溶液中,水電離的c(OH-)由大到小的順序為。
②滴定時,由b點到c點的過程中,下列各選項中數(shù)值保持不變的有。
a.c(NH+4)c(NH3?H2O)
b.c(H+)c(OH-)
c.c(NH+4)?c(OH-)c(NH3?H2O)
d.c(NH3?H2O)?c(H+)c(NH+4)
③該溫度時氨水的電離平衡常數(shù)K=。
(3)氮的氧化物易污染環(huán)境,可用氫氧化鈉溶液吸收。發(fā)生的反應為:
2NaOH+NO+NO2═2NaNO2+H2O
2NaOH+2NO2═NaNO3+NaNO2+H2O
將反應混合液和氫氧化鈉溶液分別加到如圖3所示的電解槽中進行電解,A室產(chǎn)生N2。
①電極Ⅱ是極,B室產(chǎn)生的氣體是。
②A室NO2-發(fā)生的電極反應是。組卷:0引用:2難度:0.5


