2021-2022學(xué)年遼寧省鐵嶺市六校協(xié)作體高一(下)期末化學(xué)試卷
發(fā)布:2024/4/20 14:35:0
一、單選題(每題3分、共15個(gè),總分45分)
-
1.下列各組關(guān)于強(qiáng)電解質(zhì)、弱電解質(zhì)、非電解質(zhì)的歸類,完全正確的是( )
選項(xiàng) A B C D 強(qiáng)電解質(zhì) CaCO3 NaCl HI HNO3 弱電解質(zhì) CH3COONH4 NH3 H3PO4 Fe(OH)3 非電解質(zhì) 蔗糖 BaSO4 酒精 H2O A.A B.B C.C D.D 組卷:89引用:4難度:0.7 -
2.下列說法正確的是( )
A.pH試紙?jiān)谑褂弥皯?yīng)用蒸餾水潤濕 B.用廣泛pH試紙測某鹽酸的pH=2.3 C.常溫下反應(yīng)2Na2SO3(s)+O2(g)═2Na2SO4(s)能自發(fā)進(jìn)行,則ΔH<0 D.增大壓強(qiáng)(對于氣體反應(yīng)),活化分子百分?jǐn)?shù)增大,故反應(yīng)速率增大 組卷:19引用:3難度:0.7 -
 3.已知:①反應(yīng)P4(g)+3O2(g)═P4O6(g)ΔH=-1518kJ?mol-1,②白磷(P4)、P4O6的分子結(jié)構(gòu)如圖所示;③P-P、O=O、P-O鍵的鍵能分別為akJ?mol-1、498kJ?mol-1、351kJ?mol-1。則a的值為( )
3.已知:①反應(yīng)P4(g)+3O2(g)═P4O6(g)ΔH=-1518kJ?mol-1,②白磷(P4)、P4O6的分子結(jié)構(gòu)如圖所示;③P-P、O=O、P-O鍵的鍵能分別為akJ?mol-1、498kJ?mol-1、351kJ?mol-1。則a的值為( )A.1200 B.300 C.240 D.200 組卷:58引用:2難度:0.9 -
4.在一定溫度時(shí),將1mol A和2mol B放入容積為5L的某密閉容器中發(fā)生如下反應(yīng):A(s)+2B(g)?C(g)+2D(g),經(jīng)5min后達(dá)到平衡,測得容器內(nèi)B物質(zhì)的濃度減少了0.2mol?L-1。下列敘述中不正確的是( )
A.在5 min內(nèi)該反應(yīng)用C的濃度變化表示的反應(yīng)速率為0.02mol?L-1?min-1 B.平衡時(shí)B的體積分?jǐn)?shù)為33.3% C.初始?jí)簭?qiáng)和平衡時(shí)的壓強(qiáng)比為4:5 D.平衡時(shí)B的轉(zhuǎn)化率為50% 組卷:66引用:4難度:0.7 -
5.少量鐵粉與100mL0.1mol/L的稀鹽酸反應(yīng),若想減慢此反應(yīng)速率而不改變H2的產(chǎn)量,可以使用如下方法中的( )
①加H2O ②加NaOH固體 ③滴入幾滴濃鹽酸 ④加CH3COONa固體 ⑤加NaCl溶液 ⑥滴入幾滴硫酸銅溶液 ⑦加NaNO3溶液A.①⑤⑦ B.③⑥ C.①②⑤ D.①④⑤ 組卷:168引用:5難度:0.6 -
6.高爐煉鐵過程中發(fā)生的反應(yīng):
Fe2O3(s)+CO(g)?13Fe(s)+CO2(g),已知該反應(yīng)在不同溫度下的平衡常數(shù)如表,下列說法不正確的是( )23溫度/℃ 1000 1150 1300 平衡常數(shù) 4.0 3.7 3.5 A.△H<0 B.該反應(yīng)的平衡常數(shù)表達(dá)式是K= c(CO2)c(CO)C.其他條件不變,向平衡體系充入CO2氣體,K值減小 D.其他條件不變,升高溫度時(shí),CO的平衡轉(zhuǎn)化率降低 組卷:384引用:2難度:0.7
二、填空題(共四道大題、總分55分)
-
18.二甲醚(DME)被譽(yù)為“21世紀(jì)的清潔燃料”。由合成氣制備二甲醚的主要原理如下:
①CO(g)+2H2(g)?CH3OH(g)△H 1=-90.7 kJ?mol-1 K1
②2CH3OH(g)?CH3OCH3(g)+H2O(g)△H 2=-23.5kJ?mol-1 K2
③CO(g)+H2O(g)?CO2(g)+H2(g)△H 3=-41.2kJ?mol-1 K3
回答下列問題:
(1)則反應(yīng)3H2(g)+3CO(g)?CH3OCH3(g)+CO2(g)的△H=kJ?mol-1;該反應(yīng)的平衡常數(shù)K=(用K1、K2、K3表示)
(2)下列措施中,能提高(1)中CH3OCH3產(chǎn)率的有。
A.使用過量的CO B.升高溫度 C.增大壓強(qiáng)
(3)一定溫度下,0.2molCO和0.1molH2O通入2L恒容密閉容器中,發(fā)生反應(yīng)③,5分鐘時(shí)達(dá)到化學(xué)平衡,平衡后測得H2的體積分?jǐn)?shù)為0.1.則5分鐘內(nèi)v(H2O)=,CO的轉(zhuǎn)化率α(CO)=。
(4)將合成氣以=2通入1 L的反應(yīng)器中,一定條件下發(fā)生反應(yīng):4H2(g)+2CO(g)?CH3OCH3(g)+H2O(g)△H,其CO的平衡轉(zhuǎn)化率隨溫度、壓強(qiáng)變化關(guān)系如圖1所示,下列說法正確的是n(H2)n(CO)。
A.△H<0 B.P1>P2>P3
C.若在P3和316℃時(shí),起始時(shí)n(H2)/n(CO)=3,則平衡時(shí),α(CO)小于50%
(5)采用一種新型的催化劑(主要成分是Cu-Mn的合金),利用CO和H2制備二甲醚(DME)。觀察圖2回答問題。催化劑中約為n(Mn)n(Cu)時(shí)最有利于二甲醚的合成。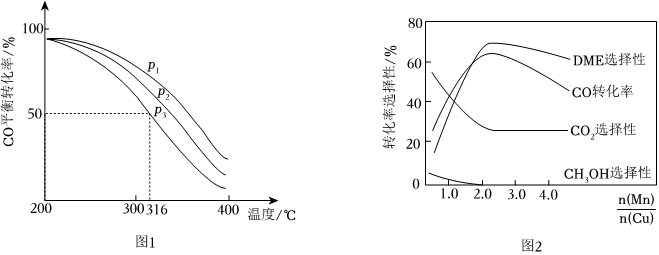 組卷:71引用:13難度:0.5
組卷:71引用:13難度:0.5 -
 19.某研究性學(xué)習(xí)小組利用H2C2O4溶液和酸性KMnO4溶液的反應(yīng)探究“外界條件的改變對化學(xué)反應(yīng)速率的影響”,進(jìn)行了如下實(shí)驗(yàn):
19.某研究性學(xué)習(xí)小組利用H2C2O4溶液和酸性KMnO4溶液的反應(yīng)探究“外界條件的改變對化學(xué)反應(yīng)速率的影響”,進(jìn)行了如下實(shí)驗(yàn):
(1)其中V1=實(shí)驗(yàn)序號(hào) 實(shí)驗(yàn)
溫度/K有關(guān)物質(zhì) 溶液顏色褪至無色所需時(shí)間/s 酸性KMnO4溶液 H2C2O4溶液 H2O V/mL c/mol?L-1 V mL c/mol?L-1 V/mL A 293 2 0.02 4 0.1 0 t1 B T1 2 0.02 3 0.1 V1 8 C 313 2 0.02 V2 0.1 1 t2 、T1=;通過實(shí)驗(yàn)(填實(shí)驗(yàn)序號(hào))可探究出溫度變化對化學(xué)反應(yīng)速率的影響,其中V2=。
(2)若t1<8,則由此實(shí)驗(yàn)可以得出的結(jié)論是;忽略溶液體積的變化,利用實(shí)驗(yàn)B中數(shù)據(jù)計(jì)算,0~8s內(nèi),用KMnO4的濃度變化表示的反應(yīng)速率v(KMnO4)=。
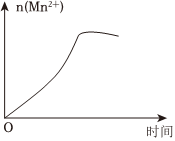
(3)該小組的一位同學(xué)通過查閱資料發(fā)現(xiàn),上述實(shí)驗(yàn)過程中n(Mn2+)隨時(shí)間的變化情況如圖所示,并認(rèn)為造成這種變化的原因是反應(yīng)體系中的某種粒子對KMnO4與草酸之間的反應(yīng)有某種特殊作用,則該作用是。組卷:25引用:5難度:0.5


