2021-2022學年新疆建設兵團農十師北屯高級中學高二(上)期中化學試卷
發布:2024/4/20 14:35:0
一、每題只有一個選項符合題意,每小題2分,共42分。
-
1.化學與人類生活、環境及社會可持續發展密切相關,下列說法錯誤的是( )
A.推廣“2020新版限塑令”有利于減少白色污染,保護環境 B.人體內葡萄糖被氧化成CO2是熱能轉變成化學能的過程 C.生活中常用鹽酸來清潔衛生潔具或去除水垢 D.2019年南陽青年汽車公司推出“水制氫”汽車,并不利于節約能源 組卷:12引用:2難度:0.6 -
2.英國俄勒岡大學的化學家使用了一種名為trans-Fe(DMeOPrPE)2的新催化劑在常溫下合成氨,反應方程式可表示為N2+3H2?2NH3。下列有關說法正確的是( )
A.新法合成氨不需要在高溫條件下進行,可節約大量能源 B.新法合成氨能在常溫下進行是因為不需要斷裂化學鍵 C.傳統合成氨方法的△H>0,新型合成氨方法的△H<0 D.新催化劑提高了活化分子百分數,加快了化學反應速率,使平衡正向移動 組卷:41引用:4難度:0.8 -
3.下列事實不能用勒夏特列原理解釋的是( )
A.密閉容器中發生:H2(g)+Br2(g)?2HBr(g),增大壓強紅棕色加深 B.向氯水中加入CaCO3固體提高HClO的濃度 C.實驗室用排飽和食鹽水的方法收集氯氣 D.合成氨工業中采用增大壓強的方法提高NH3的產量 組卷:19引用:2難度:0.6 -
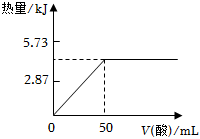 4.已知H+(aq)+OH-(aq)=H2O(l)△H=-57.3kJ/mol,向50mL 2mol/L的NaOH溶液中加入1mol/L的某種酸恰好完全反應,測得加入酸的體積與反應放出熱量的關系如下圖所示(不考慮熱量的散失),則該酸可能是( )
4.已知H+(aq)+OH-(aq)=H2O(l)△H=-57.3kJ/mol,向50mL 2mol/L的NaOH溶液中加入1mol/L的某種酸恰好完全反應,測得加入酸的體積與反應放出熱量的關系如下圖所示(不考慮熱量的散失),則該酸可能是( )A.醋酸(CH3COOH) B.鹽酸 C.草酸(HOOC-COOH) D.硫酸 組卷:383引用:4難度:0.7 -
5.同Na2CO3溶液中滴加鹽酸,反應過程中能量變化如圖所示,下列說法不正確的是( )

A.HCO3-(aq)+H+(aq)═CO2(g)+H2O(l) ΔH>0 B.ΔH1>ΔH2,ΔH2<ΔH3 C.CO32-(aq)+2H+(aq)═CO2(g)+H2O(l) ΔH=ΔH1+ΔH2+ΔH3 D.HCO3-(aq)═H+(aq)+CO32-(aq) ΔH=+|ΔH1| 組卷:19引用:3難度:0.6 -
6.現有0.1mol/L的CH3COOH溶液,下列措施一定能使溶液中c(H+)增大的是( )
A.加水 B.降溫 C.加入NaOH溶液 D.加入少量冰醋酸 組卷:32引用:2難度:0.5 -
7.已知溫度T時水的離子積常數為KW,該溫度下,將濃度為a mol?L-1的一元酸HA與b mol?L-1一元堿BOH等體積混合,可判定該溶液呈中性的依據是( )
A.a=b B.混合溶液的pH=7 C.混合溶液中,c(H+)= mol?L-1KwD.混合溶液中,c(H+)+c(B+)=c(OH-)+c(A-) 組卷:2308引用:102難度:0.9 -
8.一定溫度下,一容積可變的密閉容器中發生反應A(s)+3B(g)?2C(g)+D(g),經2minB的濃度減少0.6mol?L-1,下列說法正確的是( )
A.若起始時A、B的物質的量之比為1:3,則2min末A、B的轉化率相等 B.用A表示的反應速率是0.1mol?L-1?min-1 C.2min末的反應速率v(C)=0.2mol?L-1?min-1 D.該反應的平衡常數表達式為K= c2(C)c(D)c(A)c3(B)組卷:50引用:4難度:0.5
二、第Ⅱ卷非選擇題(共58分)
-
24.用中和滴定法測定某燒堿樣品的純度,試根據實驗回答下列問題:
(1)準確稱量8.2g含有少量中性易溶雜質的樣品,配成500mL待測溶液。 用0.100mol?L-1硫酸滴定,寫出該中和反應的熱化學方程式(中和熱△H=-57.3kJ/mol)。將該燒堿樣品配成500mL待測溶液需要的玻璃儀器有。
(3)滴定過程中,眼睛應注視,若用酚酞作指示劑達到滴定終點顏色變化是。
(4)根據下表數據,計算被測燒堿溶液的物質的量濃度是molL-1,燒堿樣品的純度是(保留小數點后兩位)
(5)下列實驗操作會對滴定結果產生什么后果?(填“偏高”“偏低”或“無影響”)滴定次數 待測溶液
體積(mL)標準酸體積 滴定前的刻度(mL) 滴定后的刻度(mL) 第一次 10.00 0.40 20.50 第二次 10.00 4.10 24.00
①觀察酸式滴定管液面時,開始俯視,滴定終點平視,則滴定結果。
②若將錐形瓶用待測液潤洗,然后再加入10.00mL待測液,則滴定結果。組卷:9引用:5難度:0.7 -
25.鎳在工業生產中有重要作用,以粗氧化鎳(主要含NiO、CoO、Fe2O3等)為原料制備純鎳的流程示意圖如下:

回答下列問題:
(1)已知C與CO的燃燒熱分別為393.5kJ?mol-1、283.0kJ?mol-1。則反應C(g)+CO2(g)?2CO(g)△H=kJ?mol-1,既有利于提高該反應的速率,又有利于提高CO2平衡轉化率的措施是。
(2)堿洗過程中發生反應的離子方程式為:。
(3)羰化反應為:Ni(s)+4CO(g)?Ni(CO)4(g)△H<0。在初始溫度相同、體積均為1L的三個密閉容器中分別進行該反應,控制不同條件,反應過程中部分數據見表:
①反應Ⅰ在該溫度下的平衡常數K=反應時間 Ni CO Ni(CO)4 反應Ⅰ:恒溫恒容 0min 足量 4mol 0 ∞ xmol 反應Ⅱ:恒溫恒壓 0min 足量 4mol 0 反應Ⅲ:絕熱恒容 0min 0 0 1mol (含x的表達式表示)。
②下列不能說明反應Ⅲ達到平衡狀態的是。
a.平衡常數K不再改變
b.Ni的質量不再改變
c.v生成[Ni(CO)4]=4v生成(CO)
d.容器內的壓強不再改變
③比較平衡時下列物理量的大小:CO的體積分數ⅠⅡ;Ni(CO)4的濃度ⅠⅢ(填“大于”、“等于”或“小于”)。
(4)羰化后的產物為Fe(CO)5、Co2(CO)8、Ni(CO)4,有關性質如下表:
蒸餾提取Ni(CO)4應選擇的適宜溫度范圍是物質 Fe(CO)5 Ni(CO)4 Co2(CO)8 沸點/℃ 106 43.2 52 熔點/℃ -20 -19.3 31 分解溫度/℃ >160 135 - 。
(5)采用較高溫度下分解Ni(CO)4(g)制取鎳。實驗證明在一定范圍內溫度越高,鎳中含碳量越高,結合平衡移動原理解釋原因:。組卷:28引用:3難度:0.5


