魯科版(2019)選擇性必修1《2.2 化學反應的限度》2023年同步練習卷(9)
發布:2024/8/17 5:0:1
一、選擇題
-
1.已知可逆反應2NO2(g)?N2O4(g),可以說明該反應已經達到平衡狀態的是( )
①v正=v逆≠0
②NO2全部轉變成N2O4
③c(NO2)=c(N2O4)
④N2O4不再分解
⑤NO2的百分含量不再改變
⑥體系的顏色不再發生變化A.①④⑥ B.①⑤⑥ C.①③⑥ D.②④⑥ 組卷:5引用:2難度:0.7 -
2.在兩個恒容的密閉容器中進行下列兩個可逆反應:
甲:C(s)+H2O(g)?CO(g)+H2(g);
乙:CO(g)+H2O(g)?CO2(g)+H2(g)
現有下列狀態:①混合氣體平均相對分子質量不再改變
②恒溫時,氣體壓強不再改變 ③各氣體組成濃度相等
④反應體系中溫度保持不變 ⑤斷裂氫氧鍵速率是斷裂氫氫鍵速率的2倍
⑥混合氣體密度不變 ⑦單位時間內,消耗水質量與生成氫氣質量比為9:1
其中能表明甲、乙容器中反應都達到平衡狀態的是( )A.①②⑤ B.③④⑥ C.⑥⑦ D.④⑤ 組卷:298引用:16難度:0.5 -
 3.某化學科研小組研究在其他條件不變時,改變某一條件對A2(g)+3B2(g)?2AB3(g)化學平衡狀態的影響,得到如圖所示變化規律(圖中T表示溫度,n表示物質的量),下列根據圖像得出的結論不正確的是( )
3.某化學科研小組研究在其他條件不變時,改變某一條件對A2(g)+3B2(g)?2AB3(g)化學平衡狀態的影響,得到如圖所示變化規律(圖中T表示溫度,n表示物質的量),下列根據圖像得出的結論不正確的是( )A.反應速率:C>B>A B.達到平衡時A2的轉化率:B>A>C C.若T2>T1,則正反應一定是吸熱反應 D.達到平衡時,AB3的物質的量:C>B>A 組卷:92引用:4難度:0.4 -
4.將NO2裝入帶活塞的密閉容器中,當反應2NO2(g)?N2O4(g)達到平衡后,改變下列一個條件,其中敘述正確的是( )
A.升高溫度,氣體顏色加深,則此反應為吸熱反應 B.慢慢壓縮氣體體積,平衡向右移動,混合氣體顏色變淺 C.慢慢壓縮氣體體積,若體積減小一半,壓強增大,但小于原來的兩倍 D.恒溫恒容時,充入少量惰性氣體,壓強增大,平衡向右移動,混合氣體的顏色變淺 組卷:134引用:20難度:0.7 -
5.在相同溫度和壓強下,對反應X(g)+Y(g)?Z(g)+W(g)進行四組實驗,實驗起始時放入容器內各組分的物質的量見下表:
上述四種情況達到平衡后,n(Z)的大小順序是( )實驗 X Y Z W ① a mol a mol 0 mol 0 mol ② 3a mol a mol 0 mol 0 mol ③ 0 mol 0 mol a mol a mol ④ 2a mol 0 mol a mol a mol A.②=④>①=③ B.②>④>①>③ C.④>②>①=③ D.④>③>②>① 組卷:17引用:2難度:0.7 -
6.已知 X(s)+Y(g)?2W(g)+M (g)△H=-a kJ?mol-1(a>0)。一定溫度下,在體積恒定的密閉容器中,加入 2 mol X(s) 與 2mol Y (g),下列說法正確的是( )
A.充分反應后,放出熱量可能為 a kJ B.當反應達到平衡狀態時,Y 與 W 的物質的量濃度之比一定為 1:2 C.當 X 的物質的量的濃度不再改變,表明該反應已達平衡 D.若減少 Y 的濃度,正反應速率減小,逆反應速率卻增大 組卷:50引用:2難度:0.5
三、解答題
-
 17.環戊二烯(
17.環戊二烯( )是重要的有機化工原料,廣泛用于農藥、橡膠、塑料等生產。回答下列問題:
)是重要的有機化工原料,廣泛用于農藥、橡膠、塑料等生產。回答下列問題:
(1)已知: (g)=
(g)= (g)+H2(g)ΔH1=+100.3kJ?mol-1①
(g)+H2(g)ΔH1=+100.3kJ?mol-1①
H2(g)+I2(g)═2HI(g)ΔH2=-11.0kJ?mol-1②
對于反應: (g)+I2(g)?
(g)+I2(g)? (g)+2HI(g) ③ΔH3=kJ?mol-1。
(g)+2HI(g) ③ΔH3=kJ?mol-1。
(2)某溫度下,等物質的量的碘和環戊烯( )在剛性容器內發生反應③,起始總壓為105Pa,平衡時總壓增加了20%,環戊烯的轉化率為 ,該反應的平衡常數Kp=Pa。達到平衡后,欲增加環戊烯的平衡轉化率,可采取的措施有( 填標號)。
)在剛性容器內發生反應③,起始總壓為105Pa,平衡時總壓增加了20%,環戊烯的轉化率為 ,該反應的平衡常數Kp=Pa。達到平衡后,欲增加環戊烯的平衡轉化率,可采取的措施有( 填標號)。
A.通入惰性氣體
B.提高溫度
C.增加環戊烯濃度
D.增加碘濃度
(3)環戊二烯容易發生聚合生成二聚體,該反應為可逆反應。不同溫度下,溶液中環戊二烯濃度與反應時間的關系如圖所示,下列說法正確的(填標號)。
A.T1>T2
B.a點的反應速率小于c點的反應速率
C.a點的正反應速率大于b點的逆反應速率
D.b點時二聚體的濃度為0.45mol?L-1組卷:90引用:5難度:0.4 -
18.對于吸熱反應2SiHCl3(g)?SiH2Cl2(g)+SiCl4(g),采用大孔弱堿性陰離子交換樹脂催化劑,在323K和343K時SiHCl3的轉化率隨時間變化的結果如圖所示。
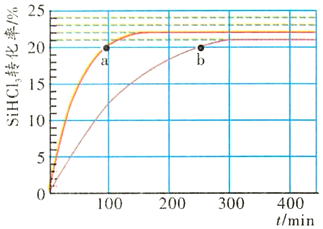
(1)343K時反應的平衡轉化率α=%。
(2)在343K下:要提高SiHCl3轉化率,可采取的措施是;要縮短反應達到平衡的時間,可采取的措施有、。
(3)比較a、b處反應速率大小:va(填“大于”“小于”或“等于”)vb。組卷:2引用:4難度:0.6


