2020-2021學年福建省福州教院附中、福州十五中高一(下)期中化學試卷
發布:2025/1/6 6:0:2
一、選擇題(包括23小題,每小題2分,共計46分。每小題只有一個選項符合題意。)
-
1.化學在資源利用、環境保護等與社會可持續發展密切相關的領域發揮著積極作用.下列做法與社會可持續發展理念相違背的是( )
A.改進汽車尾氣凈化技術,減少大氣污染物的排放 B.開發利用可再生能源,減少化石燃料的使用 C.研發可降解高分子材料,減少“白色污染” D.過度開采礦物資源,促進地方經濟發展 組卷:471引用:31難度:0.9 -
2.下列表示物質結構的化學用語或模型圖正確的是( )
A.乙烯的結構簡式為CH2CH2 B.CH4 分子的比例模型: 
C.氯離子的結構示意圖: 
D.氯化鈉的電子式:  組卷:7引用:3難度:0.9
組卷:7引用:3難度:0.9 -
3.可以獲得大量乙烯的是( )
A.天然氣液化 B.煤干餾 C.石油分餾 D.石油裂解 組卷:27引用:2難度:0.8 -
4.某原電池結構如圖所示,下列有關該原電池的說法正確的是( )
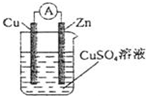
A.銅棒為負極 B.鋅棒發生還原反應 C.電子從銅棒經外電路流向鋅棒 D.鋅棒質量減輕 組卷:417引用:11難度:0.9 -
5.下列因發生加成反應而產生的現象是( )
A.乙烯使溴的四氯化碳溶液褪色 B.Cl2使品紅溶液褪色 C.SO2使品紅溶液褪色 D.光照使甲烷和氯氣混合氣體黃綠色褪去 組卷:173引用:3難度:0.8 -
6.下列說法不正確的是( )
A.12C和14C互為同位素 B.甲烷與正丁烷(CH3CH2CH2CH3)互為同系物 C.二氧化碳和干冰互為同素異形體 D.乙醇(CH3CH2OH)與二甲醚(CH3-O-CH3)互為同分異構體 組卷:76引用:10難度:0.9 -
7.下列物質中,不可以通過乙烯加成反應得到的是( )
A.CH3CH3 B.CH3CH2Br C.CH3CH2OH D.CH3CHCl2 組卷:264引用:7難度:0.7 -
8.實驗室不需要用棕色試劑瓶保存的試劑是( )
A.濃硝酸 B.硝酸銀 C.氯水 D.濃硫酸 組卷:101引用:11難度:0.9 -
9.下列過程,觀察不到顏色變化的是( )
A.NO氣體暴露在空氣中 B.往FeCl3溶液中滴入KSCN溶液 C.往氨水中滴加酚酞 D.往稀硫酸中通入氨氣 組卷:27引用:2難度:0.6
二、填空題(本大題有4小題,共54分)
-
26.Ⅰ用純凈的碳酸鈣與稀鹽酸反應制取二氧化碳氣體,請回答:

(1)實驗過程如圖1所示,分析判斷:段化學反應速率最快。
(2)為了減緩上述反應的速率,欲向溶液中加入下列物質,你認為可行的是
A.蒸餾水B.氯化鈉固體C.氯化鈉溶液D.濃鹽酸
Ⅱ某溫度時,在2L容器中X、Y、Z三種物質隨時間的變化關系曲線如圖2所示。
(3)反應開始至2minZ的平均反應速率為。
(4)5min后Z的生成速率比5min末Z的生成速率(大、小、相等)。
Ⅲ工業用硫鐵礦制備硫酸的流程如下: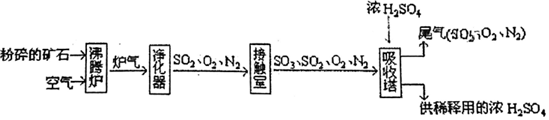
工業制備硫酸的第一階段反應FeS2+11O22 Fe2O3+8SO2,高溫
(5)粉碎礦石的目的:。
(6)若尾氣不經處理,直接排放空氣中,會造成空氣污染,產生。
(7)接觸室中發生的反應,O2+2SO2?2SO3△H=-198kJ?mol-1,如測得2h后SO2的濃度為0.6mol?L-1,此時間內O2的消耗速率為0.2mol?L-1?h-1,則開始時SO2的濃度為。組卷:33引用:1難度:0.7 -
27.某化學研究性學習小組利用如圖裝置制取并探究氨氣的性質。

[實驗探究]
(1)A裝置發生反應的化學方程式:。
(2)實驗室還可用A裝置制取。
(3)B裝置中的干燥劑可選用。
(4)C、D裝置中試紙顏色會發生變化的是。
(5)當實驗進行一段時間后,擠壓E裝置中的膠頭滴管,滴入2~3滴濃鹽酸,可觀察到瓶中產生。
(6)為防止過量氨氣造成空氣污染,需要在E裝置的末端增加一個尾氣處理裝置,從圖中選出合適的裝置。
(7)實驗室可用方法收集氨氣。
若收集到氨氣的體積為4.48L(標準狀況),則參加反應的NH4Cl的質量為。
[知識運用]
(8)氨氣的用途很廣。如可利用氨氣在催化劑存在的情況下與氧氣反應來制取生產硝酸所需要的一氧化氮:4NH3+5O24NO+6H2O,在該反應中消耗1mol氨氣轉移電子數為高溫催化劑,NO能發生下列反應:aNO+bO2+cH2O═dHNO3,從電子得失相等角度分析可知a:b=。請你列舉氨氣的另一種用途:。組卷:76引用:2難度:0.7


