2020-2021學年重慶市萬州二中高二(上)期末化學試卷
發布:2024/4/20 14:35:0
一、選擇題(共14個小題,每小題3分,滿分42分)
-
1.化學在生產生活中有著重要的應用。下列說法正確的是( )
A.不銹鋼是在鐵的表面鍍上鉻、鎳等得到的合金,具有很強的抗腐蝕能力 B.亞硝酸鈉和碳酸氫鈉水溶液均顯堿性,且都可以用作食品添加劑 C.可溶性的鋁鹽和鐵鹽能用于飲用水消毒殺菌 D.誤食重金屬鹽引起的人體中毒,可喝大量的食鹽水解毒 組卷:1引用:1難度:0.7 -
2.以下說法中正確的是( )
A.已知:C(s)+CO2(g)=2CO(g)ΔH>0,則該反應在任何條件都可以自發進行 B.對于有氣體參加的可逆反應,加壓可增大單位體積活化分子百分數,從而加快反應速率 C.冰在室溫下自動融化成水,是熵增的重要結果 D.吸熱反應都必須加熱才能發生 組卷:5引用:2難度:0.7 -
3.下列敘述正確的是( )
A.[Ar]3d64s2是基態原子的電子排布式 B.鉻原子的電子排布式是1s22s22p63s23p64s13d5 C.銅原子的價電子排布式是3d94s2 D.氮原子的電子排布圖是 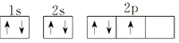 組卷:148引用:11難度:0.6
組卷:148引用:11難度:0.6 -
4.某同學設計如圖所示實驗,探究反應中的能量變化。下列判斷正確的是( )

A.由實驗可知,(a)、(b)、(c)所涉及的反應都是放熱反應 B.將實驗(a)中的鋁片更換為等質量的鋁粉后釋放出的熱量有所增加 C.實驗(c)中將環形玻璃攪拌棒改為鐵質攪拌棒對實驗結果沒有影響 D.若用NaOH固體測定中和熱,則測定結果偏高 組卷:269引用:16難度:0.8 -
5.短周期主族元素X、Y、Z、W原子序數依次增大,X原子核外有7個電子,Y在周期表中位于ⅡA族,Z與X屬于同一主族,基態W原子的核外有2個未成對電子。下列說法正確的是( )
A.原子半徑:r(X)<r(Y)<r(Z)<r(W) B.第一電離能:I1(Y)<I1(W)<I1(Z) C.Z的最高價氧化物對應水化物的酸性比X的強 D.元素Y、W的簡單離子具有相同的電子層結構 組卷:37引用:2難度:0.5 -
6.室溫下,下列有關兩種溶液的說法不正確的是( )
序號 ① ② pH 12 12 溶液 氨水 氫氧化鈉溶液 A.①②兩溶液中c(OH-)相等 B.①溶液的物質的量濃度為0.01 mol?L-1 C.①②兩溶液分別加水稀釋10倍,稀釋后溶液的pH:①>② D.等體積的①②兩溶液分別與0.01 mol?L-1的鹽酸完全中和,消耗鹽酸的體積:①>② 組卷:61引用:11難度:0.9
二、非選擇題(共4個小題,滿分58分)
-
17.已知25°C時,部分弱酸的電離常數Ka如表所示:
回答下列問題:弱酸 HSCN CH3COOH HCN H2CO3 電離常數Ka 1.3×10-1 1.8×10-5 4.9×10-10 Ka1=4.3×10-7
Ka2=5.6×10-11
(1)四種酸HSCN、CH3COOH、HCN、H2CO3的酸性從強到弱的順序是;
(2)25°C時,將0.1mol/LHSCN溶液和0.1mol/LNaOH溶液等體積混合,所得溶液呈(填“酸”、“中”或“堿”)性;相對于純水體系而言,所得溶液中水的電離程度受到(填“促進”、“抑制”或“既不促進也不抑制”)。
(3)25°C時,向20mL0.1mol/L的CH3COOH溶液中逐滴加入10mL0.1mol/LNaOH溶液,得到的混合溶液呈酸性。
①寫出混合溶液中的電荷守恒式;
②比較混合溶液中的離子濃度大小;
③針對該混合溶液,下列說法正確的是。
A.混合溶液中雖然呈酸性,但仍存在OH-
B.若向混合溶液中繼續滴加蒸餾水,溶液酸性會減弱,的數值會增大c(OH-)c(CH3COOH)c(CH3COO-)
C.混合溶液存在c(CH3COOH)-c(CH3COO-)<c(OH-)-c(H+)
D.若想要混合溶液呈中性,則可繼續向混合溶液中加入10mL0.1mol/LNaOH溶液
(4)若向20mL0.1mol/LNaCN溶液中通入少量CO2氣體,寫出發生反應的離子方程式。組卷:13引用:2難度:0.7 -
18.已知硫酸亞鐵銨晶體[(NH4)2Fe(SO4)2?6H2O,摩爾質量為392g/mol],可用作凈水劑、顏料、媒染劑、鞣革、防腐劑等,它在空氣中不易被氧化,易溶于水,不溶于乙醇。回答下列問題:
Ⅰ.制備過程
步驟1:制備硫酸亞鐵溶液:將4g鐵粉和20mL3mol/L硫酸置于錐形瓶中,保證溶液pH<2,水浴加熱至幾乎不產生氣泡,趁熱過濾掉殘余的少量鐵粉。
步驟2:獲得硫酸亞鐵銨晶體:向濾液中加入一定量的硫酸銨溶液,然后蒸發濃縮、冷卻結晶、過濾、洗滌、晾干。
(1)步驟1中,加入過量鐵粉的目的是;由于加入的鐵粉不純,反應過程中會產生少量鐵粉不純,反應過程中會產生少量H2S,可以用CuSO溶液進行吸收處理,發生的反應為,可以用CuSO4溶液進行吸收處理,發生的反應為H2S+CuSO4═CuS↓+H2SO4,試從沉淀溶解平衡的角度解釋CuS沉淀生成的原因:。
(2)步驟2中,所用到的硫酸銨溶液呈酸性,原因是(用離子方程式表示)。
Ⅱ.定量分析——氧化還原滴定法
稱取20.00g制得的硫酸亞鐵銨晶體溶于稀硫酸,加水配制成100mL溶液,取25mL于錐形瓶中,然后用0.1000mo1/L的酸性高錳酸鉀溶液進行滴定。
(3)滴定過程中高錳酸鉀溶液應裝在儀器中(填“A”或“B”)。
(4)Fe2+核外電子排布圖為,滴定過程中,被酸性高錳酸鉀溶液氧化成Fe3+,失去一個電子,其價電子變為,發生的離子方程式為;若進行平行滴定三次,消耗KMnO4溶液的體積如下表所示:
上表中第一次的數據大于后兩次的數據,其原因可能是實驗次數 第一次 第二次 第三次 消耗KMnO4溶液的體積/ml 24.52 24.02 23.98 。
A.第一次滴定前滴定管尖嘴有氣泡,滴定后氣泡消失
B.第一次滴定用的錐形瓶用待測液潤洗過
C.第一次滴定結束時,俯視讀取酸性高錳酸鉀溶液的體積
D.第一次滴定結束時,有一滴酸性高錳酸鉀溶液懸掛在滴定管尖嘴
制得的硫酸亞鐵銨晶體純度(質量分數)為(用百分數表示,保留四位有效數字)。組卷:5引用:1難度:0.6


