人教版(2019)選擇性必修1《第2章 化學反應速率與化學平衡》2023年單元測試卷(1)(1)
發布:2024/8/16 8:0:1
一、選擇題
-
1.下列有關說法正確的是( )
A.等質量的硫蒸氣和硫固體分別完全燃燒,后者放出的熱量多 B.已知C(石墨,s)=C(金剛石,s)△H>0,故金剛石比石墨穩定 C.放熱且熵增加的反應不一定能正向自發進行 D.升高溫度能增大單位體積內的活化分子數,加快反應速率 組卷:43引用:11難度:0.7 -
2.將等物質的量的A、B混合于2L的密閉容器中,發生下列反應:3A(g)+B(g)?xC(g)+2D(g),經2min后測得D的濃度為0.5mol/L,c(A):c(B)=3:5,以C表示的平均速率v(C)=0.25mol?L-1?min-1,下列說法正確的是( )
A.反應速率v(B)=0.25 mol?L-1?min-1 B.該反應方程式中,x=1 C.2min時,A的物質的量為1.5mol D.2min時,A的轉化率為60% 組卷:129引用:24難度:0.7 -
3.一定溫度下,向一密閉容器中充入一定量的N2和O2,在電火花作用下發生反應N2+O2═2NO,前4s用N2表示的反應速率為0.1mol/(L?s),則8s末NO的濃度為( )
A.1.6mol/L B.大于1.6mol/L C.小于1.6mol/L D.不能確定 組卷:204引用:4難度:0.6 -
4.已知反應CO(g)+H2O(g)?CO2(g)+H2(g)△H<0。在一定溫度和壓強下于密閉容器中,反應達到平衡。下列敘述正確的是( )
A.升高溫度,K減小 B.減小壓強,n(CO2)增加 C.更換高效催化劑,α(CO)增大 D.充入一定量的氮氣,n(H2)改變 組卷:22引用:7難度:0.5 -
5.下列由實驗得出的結論正確的是( )
選項 實驗 結論 A 常溫下,測得0.1mol/LNaA溶液的pH小于0.1mol/LNaB溶液的pH 酸性:HA<HB B 向pH=3的醋酸溶液中,加入醋酸鈉溶液,溶液pH增大 醋酸鈉溶液呈堿性 C 向2支盛有5mL不同濃度的Na2S2O3溶液的試管中同時加入5mL 0.1mol/L硫酸溶液,記錄出現渾濁的時間 探究濃度對反應速率的影響 D 向盛有2mL 0.1mol/LAgNO3的試管中滴加5滴0.1mol/LNaCl溶液,出現白色沉淀;再往試管中滴加5滴0.1mol/LKI溶液,出現黃色沉淀 Ksp(AgCl)>Ksp(AgI) A.A B.B C.C D.D 組卷:10引用:2難度:0.5 -
6.對于可逆反應:2A(g)+B(g)?2C(g);△H<0,(ω(C)代表C的質量分數)下列圖象正確的是
( )A. 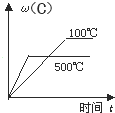
B. 
C. 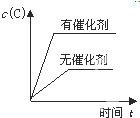
D.  組卷:28引用:3難度:0.7
組卷:28引用:3難度:0.7
三、解答題
-
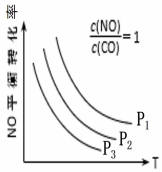 19.汽車尾氣中排放的NOx和CO污染環境,在汽車尾氣系統中裝置催化轉化器,可有效降低NOx和CO的排放。
19.汽車尾氣中排放的NOx和CO污染環境,在汽車尾氣系統中裝置催化轉化器,可有效降低NOx和CO的排放。
已知:①2CO(g)+O2(g)?2CO2(g)△H1=-566.0kJ/mol,
②N2(g)+O2(g)?2NO(g)△H2=+180.5kJ/mol,
③2NO(g)+O2(g)?2NO2(g)△H3=-116.5kJ/mol。
回答下列問題:
(1)CO的燃燒熱為。
(2)熱化學方程式2NO2(g)+4CO(g)?N2(g)+4CO2(g)△H4=
(3)為了模擬反應2NO(g)+2CO(g)?N2(g)+2CO2(g)在催化轉化器內的工作情況,控制一定條件,讓反應在恒容密閉容器中進行,用傳感器測得不同時間NO和CO的濃度如下表:
①前2s內的平均反應速率v(N2)=時間/s 0 1 2 3 4 5 c(NO)/(10-4 mol?L-1) 10.0 4.50 2.50 1.50 1.00 1.00 c(CO)/(10-3mol?L-1) 3.60 3.05 2.85 2.75 2.70 2.70 ,此溫度下,該反應的平衡常數K=。
②能說明上述反應達到平衡狀態的是。
A.2n(CO2)=n(N2)
B.混合氣體的平均相對分子質量不變
C.氣體密度不變
D.容器內氣體壓強不變
③當NO與CO濃度相等時,體系中NO的平衡轉化率與溫度、壓強的關系如圖所示,則NO的平衡轉化率隨溫度升高而減小的原因是。圖中壓強(p1、p2、p3)的大小順序為。組卷:21引用:2難度:0.5 -
20.天然氣的主要成分為CH4,一般還含有C2H6等烴類,是重要的燃料和化工原料。回答下列問題:
(1)乙烷在一定條件可發生如下反應:C2H6(g)?C2H4(g)+H2(g),2L密閉容器中通入等物質的量的乙烷和氫氣,在等壓下(p)發生上述反應,乙烷的平衡轉化率為α。反應的平衡常數Kx=(用物質的量分數代替平衡濃度計算)。
(2)已知反應CaCO3(s)=CaO(s)+CO2(g)△H(298K)=+178.2kJ?mol-1,△S(298K)=+169.6J?mol-1?K-1,則該反應能自發進行的最低溫度為K(假設反應的焓變與熵變不隨溫度變化而變化,結果保留整數)。
(3)恒溫條件下,在體積可變的密閉容器中發生反應CO(g)+2H2(g)?CH3OH(g),達到平衡時,測得CO、H2、CH3OH分別為1mol、1mol、1mol,容器的體積為3L。再往容器中通入3mol CO,此時平衡將移動(填“向右”、“向左”或“不”)。
(4)工業合成氨中制取氫氣的原理如下:
Ⅰ:CH4(g)+H2O(g)?CO(g)+3H2(g)△H=+206.4kJ?mol-1
Ⅱ:CO(g)+H2O(g)?CO2(g)+H2(g)△H=-41.2kJ?mol-1
①對于反應Ⅰ,一定可以提高平衡體系中H2百分含量,又能加快反應速率的是(填字母)。
a.升高溫度
b.增大水蒸氣濃度
c.加入催化劑
d.降低壓強
②下列措施可以提高CH4轉化率的是(填字母)。
a.適當升高溫度
b.將H2從反應體系中分離出來
c.保持體積不變充入He,使體系總壓強增大
d.按原比例再充入CH4(g)和H2O(g)
(5)乙烯(C2H4)是重要的化工原料,乙炔(C2H2)選擇性加氫合成乙烯是科學家當前關注的熱點。70℃時,反應C2H2(g)+H2(g)?C2H4(g)△H=-174kJ?mol-1在剛性容器中達到平衡。
①測得在某催化劑上生成乙烯速率方程為v=0.585[p(C2H2)]-0.36?[p(H2)]0.85,p(H2)一定時,若p1(C2H2)>p2(C2H2),則v1v2(填“>”“<”或“=”)。
②在催化劑作用下,110℃時按體積比=1:4充入剛性容器中,發生反應C2H2+H2=C2H4、C2H2+2H2=C2H6。若乙炔完全反應時,乙烯的體積分數為20%,則H2的轉化率為V(C2H2)V(H2),C2H4的選擇性為,(C2H4的選擇性=×100%)C2H4的物質的量反應的C2H2的物質的量組卷:26引用:2難度:0.6


