2022-2023學年四川省成都外國語學校高二(上)期中化學試卷
發布:2025/1/2 16:0:3
一、單選題(本大題共25小題,共26.0分)
-
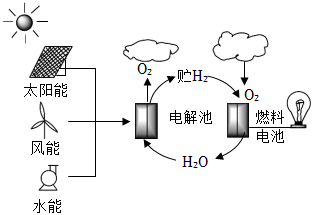 1.一種生產和利用氫能的途徑如圖所示,下列說法錯誤的是( )
1.一種生產和利用氫能的途徑如圖所示,下列說法錯誤的是( )A.由圖可知,氫能屬于二次能源 B.2H2O(l) 2H2(g)+O2(g),該過程不能自發進行電解C.太陽能、風能、氫能都屬于新能源 D.太陽能電池的供電原理與燃料電池相同 組卷:13引用:1難度:0.7 -
2.古代詩詞中蘊含著許多科學知識,下列敘述正確的是( )
A.“冰,水為之,而寒于水”說明等質量的水和冰相比,冰的能量更高 B.于謙《石灰吟》“千錘萬鑿出深山,烈火焚燒若等閑”,描述的石灰石煅燒是吸熱反應 C.曹植《七步詩》“煮豆燃豆萁,豆在釜中泣”,這里的變化只有化學能轉化為熱能 D.蘇軾《石炭?并引》“投泥潑水愈光明,爍玉流金見精悍”,所指高溫時碳與水蒸氣反應為放熱反應 組卷:191引用:11難度:0.8 -
3.已知:CH3OH(g)+3/2O2(g)=CO2(g)+2H2O(g)△H1=-akJ?mol-1
CH4(g)+2O2(g)=CO2(g)+2H2O(g)△H2=-bkJ?mol-1
CH4(g)+2O2(g)=CO2(g)+2H2O(1)△H3=-ckJ?mol-1
則下列敘述正確的是( )A.由上述熱化學方程式可知△H2<△H3 B.甲烷的燃燒熱為bkJ?mol-1 C.2CH3OH(g)=2CH4(g)+O2(g)△H=2(b-a)kJ?mol-1 D.當甲醇和甲烷物質的量之比為1:2時,其完全燃燒生成CO2和H2O(1)時,放出的熱量為QkJ,則該混合物中甲醇的物質的量為 molQ(a+2b)組卷:36引用:3難度:0.6 -
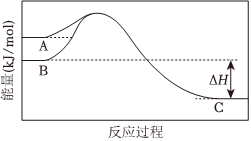 4.已知石墨比金剛石穩定。一定條件下,石墨和金剛石分別與O2發生反應的能量變化如圖所示。下列說法正確的是( )
4.已知石墨比金剛石穩定。一定條件下,石墨和金剛石分別與O2發生反應的能量變化如圖所示。下列說法正確的是( )A.A物質是石墨和O2 B.B→C的過程是放熱反應,不需要加熱 C.C物質一定是CO2(g) D.ΔH不一定代表石墨的燃燒熱 組卷:13引用:3難度:0.7 -
5.在容積不變的絕熱密閉容器中發生反應:N2(g)+3H2(g)?2NH3(g)△H<0,下列不能說明該反應達到化學平衡狀態的是( )
A.混合氣體的密度不變 B.容器溫度不變 C.3v正(NH3)=2v逆(H2) D.N2和NH3的濃度的比值不變 組卷:21引用:1難度:0.6 -
6.對于可逆反應:2SO2(g)+O2(g)?2SO3(g),下列措施能使反應物中活化分子百分數、化學反應速率和化學平衡常數都變化的是( )
A.增大壓強 B.升高溫度 C.使用催化劑 D.多充入O2 組卷:414引用:95難度:0.9 -
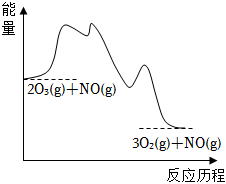 7.NO催化O3生成O2的過程由三步基元反應構成:
7.NO催化O3生成O2的過程由三步基元反應構成:
第一步:NO(g)+O3(g)=O2(g)+NO2(g)△H1;
第二步:NO2(g)=O(g)+NO(g)△H2;
第三步:O(g)+O3(g)=2O2(g)△H3。
下列說法錯誤的是( )A.該反應的中間體有三種 B.第二步、第三步反應均為放熱反應 C.總反應速率主要由第一步反應速率決定 D.NO能降低總反應的活化能 組卷:24引用:1難度:0.7 -
8.如圖所示為CFCl3破壞臭氧層的過程,下列說法不正確的是( )
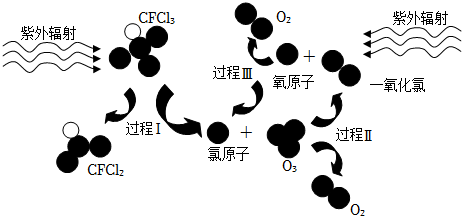
A.過程Ⅰ中斷裂極性鍵C-Cl鍵 B.過程Ⅱ可用方程式表示為O3+Cl=ClO+O2 C.過程Ⅲ中O+O=O2是吸熱過程 D.上述過程說明CFCl3中的氯原子是破壞臭氧層的催化劑 組卷:52引用:6難度:0.6 -
9.下列關于中和熱的說法正確的是( )
A.可用如圖裝置完成中和熱的測定 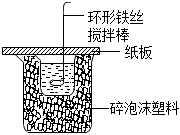
B.若用50mL0.5mol/LNaOH溶液分別與50mL0.5mol/L鹽酸和50mL0.5mol/LH2SO4溶液充分反應,兩反應測得的中和熱不相等 C.測定中和熱時,可以用保溫杯代替簡易量熱計 D.測定中和熱的實驗中,混合溶液的溫度不再變化時,該溫度為終止溫度 組卷:13引用:1難度:0.7
二、非選擇題
-
28.某化學興趣小組的同學擬設計實驗制備KMnO4,并檢驗所得產品純度。
資料:
i.MnO2與強堿在強氧化劑存在下共熔生成K2MnO4;
ii.K2MnO4溶于水,發生歧化反應生成KMnO4:3K2MnO4+2H2O?2KMnO4+MnO2↓+5KOH。
根據資料,該小組同學設計實驗方案如下:
①將KClO3和KOH固體混勻,加熱至熔融,緩慢加入MnO2,繼續加熱,得顆粒狀粗產品,提純后,溶解得K2MnO4溶液。
②向制得的K2MnO4溶液中通入適量CO2,直至K2MnO4全部轉化為KMnO4和MnO2。抽濾(減壓過濾),濾液轉入蒸發皿中,___a,抽濾(減壓過濾),洗滌,干燥,稱量,得到mg產品。
③將mg產品溶解,配成100mL溶液(待測液)。將此待測液逐滴滴入盛有25mL0.1000mol/L的H2C2O4溶液(含足量稀H2SO4)的錐形瓶中,當滴入溶液體積為VmL時H2C2O4恰好完全反應。
回答下列問題:
(1)寫出制備K2MnO4的化學方程式:。
(2)請結合化學用語,解釋進行K2MnO4的歧化反應時,通入適量CO2的目的。
(3)步驟②中第一次抽濾的目的是,a處的操作方法為。
(4)步驟③中發生反應的離子方程式為;剛開始滴入的幾滴溶液紫色褪去很慢,但再滴入幾滴后,褪色變得很快,可能的原因是。組卷:7引用:1難度:0.5 -
29.“綠水青山就是金山銀山”,研究并消除氮氧化物污染對建設美麗家鄉,打造宜居環境有重要意義。
Ⅰ.已知:2NO(g)+O2(g)=2NO2(g)ΔH1=-114kJ?mol-1
C(s)+O2(g)=CO2(g)ΔH2=-393.5kJ?mol-1
N2(g)+O2(g)=2NO(g)ΔH3=+181kJ?mol-1
若某反應的平衡常數表達式為K=,請寫出此反應的熱化學方程式c(N2)c2(CO2)c2(NO2),該反應自發進行的條件是(填“高溫”或“低溫”或“任何溫度”)。
Ⅱ.為避免汽車尾氣中的有害氣體對大氣的污染,需給汽車安裝尾氣凈化裝置。在凈化裝置中發生反應2NO(g)+2CO(g)2CO2(g)+N2(g)ΔH1=-746.8kJ?mol-1。催化劑加熱
(1)T℃時,將體積比為1:1的CO和NO的混合氣體充入剛性容器中發生上述反應,每隔一定時間測得容器內的壓強如下表所示:
①反應開始10min內,以CO的壓強變化表示該反應的平均反應速率為時間/min 0 10 20 30 40 50 60 kPa 1.08 1.02 0.97 0.93 0.90 0.90 0.90 kPa?min-1時,該反應的平衡常數Kp=kPa-1(用分數表示,Kp為用各氣體分壓表示的平衡常數)。
②反應達到平衡后,若再向容器中加入2molCO2(g)和1molN2,再次達到平衡時NO的百分含量將(填“增大””減小”或”不變”)。
(2)實驗測得,v正=k正?c2(NO)?c2(CO),v逆=k逆?c(N2)?c2(CO2)(k正、k逆為速率常數,只與溫度有關)。
①達到平衡后,僅升高溫度,k正增大的倍數(填“>”“<”或“=”)k逆增大的倍數。
②若在1L的密閉容器中充入1molCO和1molNO,在一定溫度下達到平衡時,CO的轉化率為40%,則=k正k逆。組卷:39引用:1難度:0.3


