2020-2021學年吉林省延邊州琿春第一高級中學高二(上)期中化學試卷
發布:2024/4/20 14:35:0
一、選擇題(每題只有一個選項正確,每題3分,共60分)
-
1.下列電離方程式錯誤的是( )
A.(NH4)2SO4溶于水:(NH4)2SO4═2NH4++SO42- B.H3PO4溶于水:H3PO4═3H++PO43- C.HF溶于水:HF?H++F- D.NaHS溶于水:NaHS═Na++HS-,HS-?H++S2- 組卷:85引用:7難度:0.9 -
2.下列有關敘述中正確的是( )
A.強電解質在水溶液中的電離過程是不可逆的 B.CO2的水溶液能導電,所以CO2是電解質 C.碳酸鈣在水里的溶解度很小,所以碳酸鈣是弱電解質 D.強電解質的水溶液導電能力一定比弱電解質的水溶液導電能力強 組卷:102引用:3難度:0.7 -
3.保持溫度不變,用水稀釋1mol/L的醋酸溶液至0.01mol/L,隨溶液的稀釋,下列各項中始終保持增大趨勢的是( )
A. c(H+)c(CH3COOH)B. c(CH3COO-)c(H+)C. c(CH3COOH)c(CH3COO-)D. c(H+)?c(CH3COO-)c(CH3COOH)組卷:63引用:2難度:0.5 -
4.四氯化鈦是乙烯聚合催化劑的重要成分,制備反應如下:
①TiO2 (s)+2Cl2 (g)=TiCl4 (g)+O2 (g)△H 1 =+175.4 kJ?mol-1
②C(s)+O2 (g)=CO (g)△H 2 =-110.45 kJ?mol-112
下列說法正確的是( )A.C的燃燒熱是-110.45 kJ?mol-1 B.若反應①中使用催化劑加快反應速率,單位時間內吸收更多熱量,則△H 1變大 C.反應①中的能量變化如圖所示 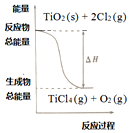
D.反應TiO2(s)+2Cl2(g)+2C(s)=TiCl4(g)+2CO(g)△H=-45.5 kJ?mol-1 組卷:12引用:4難度:0.6 -
5.在CH3COOH溶液中存在如下平衡:CH3COOH?CH3COO-+H+.加入少量下列物質或采取下述方法,能使平衡逆向移動的是( )
A.加水 B.CH3COONa固體 C.升溫 D.NaCl固體 組卷:50引用:7難度:0.7 -
6.常溫下,下列說法正確的是( )
A.稀釋酸溶液,溶液中所有離子的濃度均減小 B.用CH3COOH溶液做導電性實驗,燈泡很暗,說明CH3COOH是弱電解質 C.相同物質的量濃度的鹽酸與醋酸分別稀釋相同倍數,稀釋后溶液pH:鹽酸<醋酸 D.pH=3的醋酸溶液與pH=11的氫氧化鈉溶液等體積混合,混合液呈堿性 組卷:33引用:5難度:0.7 -
7.由合成氣制備二甲醚的主要原理如下.下列有關說法正確的是( )
①CO(g)+2H2(g)?CH3OH(g)△H1=-90.7kJ?mol-1
②2CH3OH(g)?CH3OCH3(g)+H2O(g)△H2=-23.5kJ?mol-1
③CO(g)+H2O(g)?CO2(g)+H2(g)△H3=-41.2kJ?mol-1.A.升高溫度能加快反應②的化學反應速率,提高CH3OCH3產率 B.反應③使用催化劑,△H3減少 C.反應 3H2(g)+3CO(g)?CH3OCH3(g)+CO2(g)的△H=-246.lkJ?mol-1 D.反應③對反應②無影響 組卷:9引用:4難度:0.7 -
8.若溶液中由水電離產生的c(OH-)=10-12 mol?L-1,滿足此條件的溶液中一定可以大量共存的是( )
A.Al3+、Na+、NO3-、CO32- B.K+、Na+、Cl-、NO3- C.K+、Na+、Cl-、S2- D.K+、NH4+、SO42-、NO3- 組卷:21引用:3難度:0.6
二.填空題(共40分)
-
23.在80℃時,將0.4mol的四氧化二氮氣體充入2L已抽空的固定容積的密閉容器中,隔一段時間對該容器內的物質進行分析,得到如下數據:
反應進行至100s后將反應混合物的溫度降低,發現氣體的顏色變淺.時間(s)
C(mol/L)0 20 40 60 80 100 C(N2O4) 0.20 a 0.10 c d e C(NO2) 0.00 0.12 b 0.22 0.22 0.22
(1)該反應的化學方程式為,表中bc(填“<”、“=”或“>”).
(2)0~20s內N2O4的平均反應速率為.
(3)該反應的平衡常數表達式K=,在80℃時該反應的平衡常數K值為(保留2位小數).組卷:4引用:2難度:0.5 -
24.用中和滴定法測定某燒堿樣品的純度,試根據實驗回答下列問題:
(1)準確稱量8.2g含有少量中性易溶雜質的樣品,配成500 mL待測溶液。稱量時,樣品可放在(填字母)稱量。
A.小燒杯中
B.潔凈紙片上
C.托盤上
(2)滴定時,用0.200 0 mol?L-1的鹽酸來滴定待測溶液,不可選用(填字母)作指示劑。
A.甲基橙
B.石蕊
C.酚酞
(3)滴定過程中,眼睛應注視。
(4)根據下表數據,計算被測燒堿溶液的物質的量濃度是mol?L-1,燒堿樣品的純度是。
(5)下列實驗操作會對滴定結果產生什么后果?(填“偏高”“偏低”或“無影響”)滴定次數 待測溶液
體積(mL)標準酸體積 滴定前的
刻度(mL)滴定后的
刻度(mL)第一次 10.00 0.40 20.50 第二次 10.00 4.10 24.00
①觀察酸式滴定管液面時,開始俯視,滴定終點平視,則滴定結果。
②滴定管用蒸餾水洗凈后,未用已知濃度的標準溶液潤洗,使滴定結果。
③錐形瓶未用待裝溶液潤洗,使滴定結果。組卷:35引用:4難度:0.6


