2021-2022學年江西省宜春市豐城九中(日新班)高一(上)期末化學試卷
發布:2024/12/6 22:30:1
一、單項選擇題(12小題,每小題3分,共36分。)
-
 1.高鐵、移動支付、共享單車、網購,被稱為中國“新四大發明”。用于高鐵和共享單車制造業的重要金屬材料是( )
1.高鐵、移動支付、共享單車、網購,被稱為中國“新四大發明”。用于高鐵和共享單車制造業的重要金屬材料是( )A.Na-K合金 B.Cu-Sn合金 C.Sn-Pb合金 D.Mg-Al合金 組卷:102引用:6難度:0.8 -
2.下列離子能大量共存的是( )
A.使無色酚酞試液呈紅色的溶液中:Na+、K+、CO32-、SO42- B.含有大量Ba(NO3)2的溶液中:Mg2+、NO3-、SO42-、Cl- C.無色透明的溶液中:Cu2+、K+、NO3-、SO42- D.使紫色石蕊試液呈紅色的溶液中:Na+、K+、CO32-、NO3- 組卷:6引用:4難度:0.7 -
3.設NA為阿伏加德羅常數的數值,下列說法正確的是( )
A.等物質的量的FeCl2與FeCl3,前者比后者少NA個氯離子 B.16g CH4和18g NH3所含質子數均為10NA C.1mol過氧化鈉與足量水反應時,轉移電子的數目為2NA D.常溫常壓下,相同體積的Cl2、HCl含有的分子數和原子數均相同 組卷:29引用:2難度:0.7 -
4.下列說法錯誤的是( )
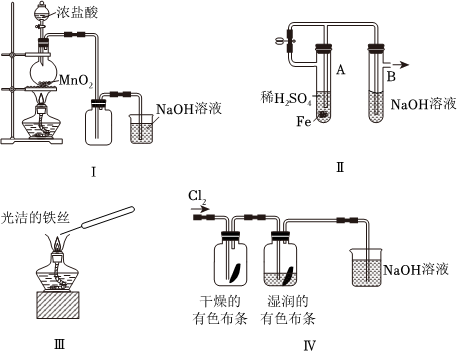
A.圖Ⅰ:若MnO2過量,則濃鹽酸就可全部消耗 B.圖Ⅱ:可利用該裝置制備Fe(OH)2并較長時間保持顏色不變 C.圖Ⅲ:可利用該實驗直接觀察純堿中鈉元素的焰色反應 D.圖Ⅳ:利用該實驗裝置可證明起漂白作用的不是Cl2 組卷:33引用:3難度:0.6 -
5.Cl2在70℃的NaOH水溶液中能同時發生兩個自身氧化還原反應,生成的產物為NaClO、NaClO3、NaCl.反應完全后,測得溶液中NaClO與NaClO3 物質的量之比為5:1,則溶液中NaCl與NaClO3的物質的量之比為( )
A.9:4 B.6:1 C.10:1 D.11:1 組卷:64引用:4難度:0.5 -
6.某學習小組擬用手持技術對新制飽和氯水進行檢測,下列圖象變化最有可能是其檢測結果的是( )
A. 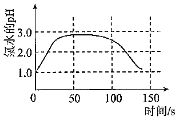
氯水pH隨時間的變化B. 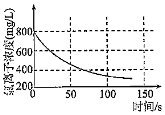
溶液中氯離子濃度隨時間的變化C. 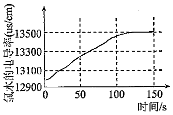
氯水的電導率隨時間的變化D. 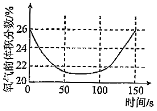
液面上方氧氣體積分數隨時間的變化組卷:341引用:12難度:0.5
三.填空題(共3個大題,每空2分,共52分)
-
18.我國化學家侯德榜發明了聯合制堿法,對世界制堿工業做出了巨大貢獻。聯合制堿法的主要過程如圖所示(部分物質已略去)。
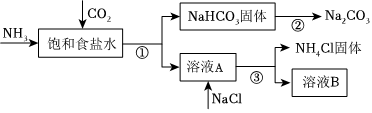
(1)①~③所涉及的操作方法中,包含過濾的是(填序號)。
(2)根據如圖,將化學方程式補充完整:NH3+CO2++=NaHCO3↓+NH4Cl。
(3)步驟②的化學方程式是。
(4)關于上述過程,下列說法中正確的是(填字母)。
a.CO2可循環使用
b.副產物NH4Cl可用作肥料
c.溶液B中一定含有Na+、、Cl-NH+4組卷:37引用:1難度:0.7 -
19.氯氣和漂白粉是現代工業和生活中常用的殺菌消毒劑,某興趣小組利用所給儀器在實驗室制備純凈干燥的氯氣,并模擬工業制漂白粉。請回答下列問題:
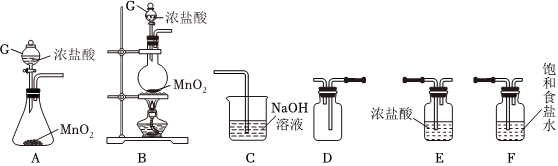
Ⅰ.(1)裝置F的作用為。
(2)從圖中選擇合適裝置制備并收集純凈干燥的氯氣(儀器不重復使用),儀器連接順序為(用儀器下方字母表示,如A→B→…)。
(3)制備氯氣的反應中體現了濃鹽酸的性和性。
Ⅱ.漂白粉的制備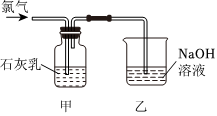
已知:①氯氣和石灰乳在反應的過程中會放出熱量。
②6Cl2+6Ca(OH)25CaCl2+Ca(ClO3)2+6H2O。△
(4)①寫出制取漂白粉的化學方程式,并用雙線橋標注電子轉移的方向和數目。
②興趣小組制得的漂白粉中CaCl2的含量遠超過預期,而Ca(ClO)2含量明顯偏低。主要原因可能是(請用化學方程式結合文字表述)。
(5)為提高產品中有效成分Ca(ClO)2的含量,在不改變石灰乳濃度和體積的條件下可采取的措施是(任寫一種即可)。組卷:10引用:1難度:0.6


