2020-2021學年吉林省長春市二道區清蒲中學高二(上)期中化學試卷
發布:2024/11/17 14:0:2
一.單項選擇題(每小題3分,共計48分)
-
1.某化學反應過程的能量變化如圖所示.下列說法正確的是( )
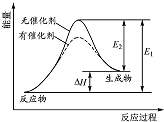
A.該反應的反應物總能量高于生成物總能量 B.使用催化劑可以增大該反應的反應熱 C.該化學反應的反應熱為E1,且反應放熱 D.化學反應在物質變化的同時,必然伴隨能量變化 組卷:28引用:3難度:0.9 -
2.N2H4是一種高效清潔的火箭燃料。已知在25℃、101 kPa下,8gN2H4(g)完全燃燒生成氮氣和液態水時,放出133.5 kJ熱量。則下列熱化學方程中正確的是( )
A.N2H4(g)+O2(g)═N2(g)+2H2O(g)△H=-534kJ?mol-1 B.N2H4(g)+O2(g)═N2(g)+2H2O(l)△H=-133.5kJ?mol-1 C.N2H4(g)+O2(g)═N2(g)+2H2O(l)△H=+534kJ?mol-1 D.N2H4(g)+O2(g)═N2(g)+2H2O(l)△H=-534kJ?mol-1 組卷:175引用:9難度:0.6 -
3.下列說法或表示方法不正確的是( )
A.蓋斯定律實質上是能量守恒定律的體現 B.在稀溶液中:H+(aq)+OH-(aq)=H2O(l)△H=-57.3kJ/mol,若將含0.5mol H2SO4的濃硫酸與含1molNaOH的溶液混合,放出的熱量大于57.3kJ C.由C(石墨)→C(金剛石)△H=+73 kJ/mol,可知石墨比金剛石穩定 D.在101kPa時,2gH2完全燃燒生成液態水,放出285.8kJ熱量,氫氣燃燒的熱化學方程式表示為:2H2(g)+O2(g)=2H2O(l)△H=-285.8kJ/mol 組卷:75引用:12難度:0.9 -
4.某同學通過實驗測出稀鹽酸和稀NaOH溶液(堿稍過量)反應的中和熱ΔH=-52.3 kJ?mol-1,造成這一結果的原因不可能的是( )
A.實驗裝置保溫、隔熱效果差 B.用量筒量取鹽酸時仰視讀數 C.分多次將NaOH溶液倒入小燒杯中 D.用測量鹽酸的溫度計直接測定NaOH溶液的溫度 組卷:10引用:1難度:0.7 -
5.在同溫同壓下,下列各組熱化學方程式中,△H1>△H2的是( )
A.2H2(g)+O2(g)=2H2O(l)△H1 2H2(g)+O2(g)=2H2O(g)△H2 B.S(g)+O2(g)=SO2(g)△H1 S(s)+O2(g)=SO2(g)△H2 C.C(s)+O2(g)=CO(g)△H1 C(s)+O2(g)=CO2(g)△H2 D.H2(g)+Cl2(g)=2HCl(g)△H1 H2(g)+12Cl2(g)=HCl(g)△H212組卷:39引用:2難度:0.7 -
6.已知:(1)Zn(s)+
O2(g)═ZnO(s),△H=-348.3kJ/mol12
(2)2Ag(s)+O2(g)═Ag2O(s),△H=-31.0kJ/mol12
則Zn(s)+Ag2O(s)═ZnO(s)+2Ag(s)的△H等于( )A.-317.3kJ/mol B.-379.3kJ/mol C.-332.8kJ/mol D.+317.3 kJ/mol 組卷:176引用:52難度:0.9 -
7.0.3mol氣態高能燃料乙硼烷B2H6在O2中燃燒,生成固態B2O3和液態H2O,放出649.5kJ的熱量.下列熱化學方程式正確的是( )
A.B2H6(g)+3O2(g)═B2O3(s)+3H2O(l)△H=+2165 kJ?mol-1 B.B2H6(g)+3O2(g)═B2O3(s)+3H2O(l)△H=-2165 kJ?mol-1 C.B2H6+3O2═B2O3+3H2O△H=-2165 kJ?mol-1 D.B2H6(g)+3O2(g)═B2O3(s)+3H2O(g)△H=-2165 kJ?mol-1 組卷:32引用:6難度:0.9
二、解答題(共5小題,滿分52分)
-
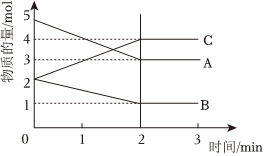 20.某反應在體積為5L的恒容密閉容器中進行,在0-3分鐘內各物質的量的變化情況如圖所示(A,B,C均為氣體,且A氣體有顏色)。
20.某反應在體積為5L的恒容密閉容器中進行,在0-3分鐘內各物質的量的變化情況如圖所示(A,B,C均為氣體,且A氣體有顏色)。
(1)該反應的化學方程式為。
(2)反應開始至2分鐘時,B的平均反應速率為。
(3)能說明該反應已達到平衡狀態的是。
a.v(A)=2v(B) b.容器內各物質的物質的量相等
c.v逆(A)=v正(C) d.容器內氣體的顏色保持不變
(4)由圖求得平衡時A的轉化率為。組卷:4引用:3難度:0.6 -
21.恒溫恒容下,將2mol氣體A和2mol氣體B通入體積為2L的密閉容器中,發生如下反應:2A(g)+B(g)?xC(g)+2D(s),2min后反應達到平衡狀態,此時剩余1.2molB,并測得C的濃度為1.2mol/L.
(1)從開始反應至達到平衡狀態,生成C的平均反應速率為.
(2)x=.
(3)A的轉化率與B的轉化率之比為.
(4)下列各項可作為該反應達到平衡狀態的標志是(填字母).
A.壓強不再變化 B.氣體密度不再變化
C.氣體平均相對分子質量不再變化 D.A的消耗速率與B的消耗速率之比為2:1.組卷:20引用:8難度:0.5


