2022-2023學年江蘇省南通市海安高級中學(創新班)高二(上)第一次月考化學試卷
發布:2024/11/27 18:30:6
一、單項選擇題(本題包14小題,每小題3分,共42分。每小題只有一個選項符合題意)
-
1.化學與生活、科技、社會發展息息相關。下列有關說法錯誤的是( )
A.德爾塔(Delta),是新冠病毒變異毒株,傳播性更強,其成分含有蛋白質 B.市面上的防曬衣通常用聚酯纖維材料制作,忌長期用肥皂或堿性較強的液體洗滌 C.“天和”核心艙電推進系統中的霍爾推力器腔體,使用的氮化硼陶瓷基復合材料屬無機非金屬材料 D.中芯國際是我國生產芯片的龍頭企業,所生產芯片的主要成分是二氧化硅 組卷:287引用:8難度:0.6 -
2.肼(N2H4)是發射航天飛船常用的高能燃料,可通過反應2NH3+NaClO=N2H4+NaCl+H2O制備。下列有關微粒的描述不正確的是( )
A.NH3的電子式為 
B.N2H4的結構式為 
C.Cl-的結構示意圖: 
D.NaClO中存在離子鍵和共價鍵 組卷:76引用:6難度:0.8 -
3.C和H2在生產、生活、科技中是非常重要的燃料。已知:
①2C(s)+O2(g)=2CO(g) ΔH=-221kJ?mol-1
② 2H2O(g)
2H2O(g)
下列推斷正確的是( )A.C(s) 的燃燒熱為110.5kJ?mol-1 B.2H2(g)+O2(g)=2H2O(g) ΔH>0,ΔS<0,該反應是非自發反應 C.C(s)+H2O(g)=CO(g)+H2(g) ΔH=+131.5kJ?mol-1 D.將2molH2O(g)分解成H2(g)和O2(g),至少需要提供4×463kJ的熱量 組卷:31引用:6難度:0.7 -
4.CO2是一種常見溫室氣體,也是巨大的碳資源。CO2可轉化為CO、H2等燃料:CO2(g)+CH4(g)=2CO(g)+2H2(g) ΔH1=+247kJ?mol-1,下列關于反應CO2(g)+CH4(g)=2CO(g)+2H2(g) ΔH1=+247kJ?mol-1的說法正確的是( )
A.該反應在任何溫度下都可自發進行 B.反應CO2(s)+CH4(g)=2CO(g)+2H2(g) ΔH2<+247kJ?mol-1 C.反應中每生成1molH2,轉移電子的數目為3×6.02×1023 D.選擇高效催化劑可以降低反應的焓變,提高化學反應速率 組卷:18引用:1難度:0.7 -
5.對于反應2SO2(g)+O2(g)?2SO3(g) ΔH=-196.6kJ?mol-1,下列說法正確的是( )
A.反應的ΔH<0,ΔS>0 B.反應的平衡常數可表示為K= c2(SO2)?c(O2)c2(SO3)C.使用催化劑能改變反應路徑,降低反應的活化能 D.增大體系的壓強能增大活化分子百分數,加快反應的速率 組卷:65引用:3難度:0.5 -
6.在恒溫條件下,向盛有食鹽的2L恒容密閉容器中加入0.2molNO2、0.2molNO和0.1molCl2,發生如下兩個反應:
①2NO2(g)+NaCl(s)?NaNO3(s)+ClNO(g)ΔH1<0平衡常數K1,②2NO(g)+Cl2(g)?2ClNO(g)ΔH2<0平衡常數K2,10min時反應達到平衡,測得容器內體系的壓強減少20%,10min內用ClNO(g)表示的平均反應速率v(ClNO)=7.5×10-3mol/(L?min).下列說法正確的是( )A.反應4NO2(g)+2NaCl(s)?2NaNO3(s)+2NO(g)+Cl2(g)的平衡常數為K12-K2 B.平衡后c(NO)=2.5×10-2mol/L C.平衡時NO2的轉化率為50% D.其它條件保持不變,反應在恒壓條件下進行,則平衡常數K2增大 組卷:18引用:2難度:0.6
二、解答題(共4小題,滿分58分)
-
 17.碘是一種人體必需的微量元素,國家標準規定合格加碘食鹽(主要含有KI和KIO3)中碘元素含量為20~50mg?kg-1。測定加碘食鹽中碘元素含量的操作過程如下。
17.碘是一種人體必需的微量元素,國家標準規定合格加碘食鹽(主要含有KI和KIO3)中碘元素含量為20~50mg?kg-1。測定加碘食鹽中碘元素含量的操作過程如下。
步驟1:準確稱取某加碘食鹽樣品100.0g,溶于水配制成500.00mL溶液。
步驟2:取步驟1所配溶液50.00mL加入碘量瓶中,向其中加入適量H2C2O4-H3PO4混合溶液。再加入NaClO溶液將碘元素全部轉化為,剩余的NaClO被H2C2O4還原除去。IO-3
步驟3:向步驟2所得溶液中加入足量的KI溶液,充分反應。
步驟4:用3.000×10-3mol?L-1Na2S2O3標準溶液滴定步驟3所得溶液至呈淺黃色時,加入淀粉溶液,繼續滴定至終點,消耗Na2S2O3標準溶液10.00mL。
已知:2Na2S2O3+I2═Na2S4O6+2NaI。
(1)步驟2中NaClO與KI反應的離子方程式為。
(2)步驟4中,Na2S2O3標準溶液(呈堿性),應盛放在如圖所示的滴定管中(填“A”或“B”)。滴定終點的現象是。
(3)通過計算確定該加碘食鹽樣品中碘元素含量是否合格(寫出計算過程)。組卷:11引用:2難度:0.5 -
18.不同催化劑作用下NH3還原NOx的機理與效果是研究煙氣(含NOx、O2、N2等)脫硝的熱點。
(1)NH3還原NO的主反應為4NH3(g)+4NO(g)+O2(g)═4N2(g)+6H2O(g)。已知:N2(g)+O2(g)═2NO(g)ΔH=+180.5kJ?mol-1,4NH3(g)+3O2(g)═2N2(g)+6H2O(g)ΔH=-1269kJ?mol-1。上述主反應的ΔH=。
(2)在某釩催化劑中添加一定量Cu2O可加快NO的脫除效率,其可能機理如圖所示(*表示物種吸附在催化劑表面,部分物種未畫出)。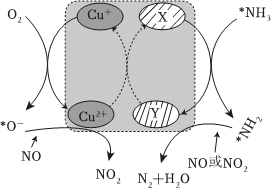
①X、Y處V元素化合價為+4或+5價。X處V元素化合價為。
②NO轉化為N2的機理可描述為。
③煙氣中若含有SO2,會生成NH4HSO4堵塞催化劑孔道。生成NH4HSO4的化學方程式為。
(3)將模擬煙氣(一定比例NOx、NH3、O2和N2)以一定流速通過裝有Fe/Zr催化劑的反應管,測得NOx轉化率隨溫度變化的曲線如圖所示。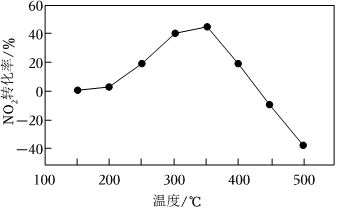
①溫度低于350℃時,NOx轉化率隨溫度升高而增大,其可能原因是。
②溫度高于450℃時,NOx轉化率已降低為負值,其可能原因是。組卷:49引用:4難度:0.7


