2021-2022學年江蘇省無錫市普通高中高一(上)期末化學試卷
發布:2024/4/20 14:35:0
一、選擇題(本題包括20小題,每小題3分,共60分。每小題只有一個選項符合題意)
-
1.氯氣與氫氧化鈉溶液反應制得的消毒液能有效抑制新型冠狀病毒。下列關于該消毒液的敘述錯誤的是( )
A.屬于混合物 B.有效成分為NaCl C.暴露空氣中會變質 D.殺菌消毒時體現有效成分的強氧化性 組卷:47引用:5難度:0.9 -
2.“慈石能引鐵”(慈,舊作磁)。“慈石”的主要成分是( )
A.Fe3O4 B.Fe2O3 C.Al2O3 D.FeO 組卷:85引用:3難度:0.7 -
3.下列物質中不含共價鍵的是( )
A.H2 B.H2S C.NaOH D.NaCl 組卷:35引用:2難度:0.7 -
4.分類法是學習化學的重要方法。下列物質或變化能按照對應的分類標準歸類的是( )
選項 物質或變化 分類標準 A Na2O、CO2、Fe2O3 堿性氧化物 B Fe、Cl、O 主族元素 C 礦泉水、泥漿水、蒸餾水混合物 混合物 D 鐵絲燃燒、鋼鐵生銹、鹽酸除銹 化學變化 A.A B.B C.C D.D 組卷:32引用:2難度:0.9 -
5.下列敘述正確的是( )
A.Cl2的水溶液可以導電,所以Cl2屬于電解質 B.NaCl屬于電解質,所以固體NaCl能導電 C.液態氯化氫不導電,但其屬于電解質 D.KNO3溶液在電流的作用下電離成K+和NO3- 組卷:72引用:3難度:0.7 -
6.用化學用語表示2Na+2H2O=2NaOH+H2↑中的相關粒子。下列敘述正確的是( )
A.中子數為8的氧原子: O816B. H、11H、21H表示同一種核素31C.H2O的結構式: 
D.NaOH的電子式:  組卷:32引用:3難度:0.8
組卷:32引用:3難度:0.8 -
7.等物質的量的Na2CO3和NaHCO3分別與足量的同濃度鹽酸充分反應,其中( )
A.Na2CO3放出的CO2多 B.NaHCO3放出的CO2多 C.Na2CO3放出CO2的速率快 D.NaHCO3放出CO2的速率快 組卷:315引用:6難度:0.9
二、解答題(共3小題,滿分40分)
-
22.某小組設計了如圖所示的實驗裝置來探究過氧化鈉的強氧化性。
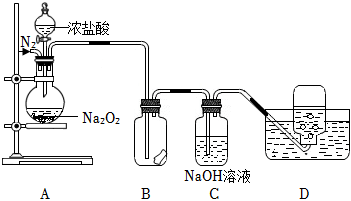
實驗步驟及現象如下:
①檢查裝置氣密性后,裝入藥品并連接裝置A、B、C。
②緩慢通入一定量的N2后,將裝置D連接好(導管末端未伸入集氣瓶中),再向圓底燒瓶中緩慢滴加濃鹽酸,A中劇烈反應,有黃綠色氣體產生。
③待裝置D中導管口產生連續氣泡后,將導管末端伸入集氣瓶中,收集到無色氣體。
④反應一段時間后,停止滴加濃鹽酸,再通一段時間N2,直至裝置中氣體變為無色。
(1)裝置D中收集的無色氣體X能使帶火星的木條復燃,據此推斷該氣體X是。
(2)裝置B中濕潤的淀粉碘化鉀試紙變藍。甲同學根據A中氣體的顏色推測試紙變藍時發生反應的離子方程式為;乙同學認為使試紙變藍的原因也可能是(填序號)。
a.揮發的HCl氣體使試紙變藍
b.在此實驗過程中生成的X氣體也能將I-氧化為I2
c.通入的N2使試紙變藍
(3)C中NaOH溶液的作用是。
(4)Na2O2與干燥的HCl能發生化學反應生成Cl2、NaCl和H2O,該反應的化學方程式為,當反應生成標準狀況下2.24LCl2時,轉移的電子數為mol。組卷:109引用:3難度:0.5 -
23.用工業廢渣(主要含有Fe2O3、FeO、Al2O3及少量Fe)制備綠礬FeSO4?7H2O晶體的流程如圖:

(1)“浸泡”過程中加入過量NaOH溶液的目的是。
(2)“溶解”后所得溶液中含有的金屬陽離子為Fe3+和,檢驗此溶液中Fe3+可使用的試劑是。
(3)“還原”時選擇FeS2而不用Cu粉的原因是。
(4)測定綠礬中Fe2+的氧化率實驗方案如下:
步驟一:稱取一定質量的綠礬樣品,將其溶于適量的無氧蒸餾水并配成250mL溶液;
步驟二:取步驟一中配得的溶液25.00mL于錐形瓶,并加入適量稀硫酸酸化,逐滴滴加0.0400mol/LKMnO4溶液至恰好完全反應(反應原理為:MnO4-+5Fe2++8H+=Mn2++5Fe3++4H2O),消耗KMnO4溶液20.00mL;
步驟三:另取步驟一中配得的溶液25.00mL于燒杯,加入足量氨水,將沉淀過濾、洗滌、干燥,在空氣中灼燒至固體質量不再變化,稱得殘留紅棕色固體的質量為0.4g。
①步驟三中灼燒所得殘留固體的化學式為。
②已知:Fe2+的氧化率=×100%。根據以上數據,計算該綠礬樣品中Fe2+的氧化率,寫出計算過程被氧化的Fe2+的質量原物質中Fe2+的總質量。組卷:85引用:3難度:0.5


