2019-2020學年浙江省杭州市高三(上)適應性化學試卷
發布:2024/11/30 16:0:2
一、選擇題(本大題共14小題,每小題3分,共42分.每小題列出的四個備選項中只有一個是符合題目要求的,不選,多選,錯選均不得分)
-
1.化學和健康息息相關,下列說法正確的是( )
A.鋁雖然在體內積累對人體有害,但鋁易形成致密的氧化膜,所以可以用鋁制品來盛放腌制品 B.缺鐵性貧血時服用的藥物主要是補充二價鐵,和維生素C一起服用能促進鐵的吸收 C.加碘鹽是在食鹽中添加KI,可以防治缺碘性疾病 D.碳酸氫鈉和氫氧化鋁都可用于治療胃潰瘍 組卷:44引用:3難度:0.8 -
2.NA表示阿伏加德羅常數,下列說法中正確的是( )
A.1mol明礬如果完全水解,產生NA個Al(OH)3膠粒 B.0.1mol羥基中含0.9NA個電子 C.1.8g重水(D2O)中含NA個氧原子 D.標準狀況下11.2LCCl4中含4mol氯原子 組卷:15引用:3難度:0.8 -
3.下列說法正確的是( )
A.葡萄糖在一定條件下可以水解生成乙醇和二氧化碳 B.進行淀粉水解實驗時,為檢驗水解產物和水解是否完全,加液順序通常如下:淀粉溶液→H2SO4溶液→NaOH溶液→碘水→新制Cu(OH)2懸濁液 C.制備乙酸乙酯時,向乙醇中緩慢加入濃硫酸和冰醋酸,加熱;將導氣管插入飽和Na2CO3溶液中以便于除去乙醇和乙酸 D.等質量的甲醛、乙酸、葡萄糖充分燃燒,消耗氧氣的質量相等 組卷:19引用:5難度:0.6 -
4.下列對應的離子方程式正確的是( )
A.酸性高錳酸鉀溶液和草酸溶液反應:2MnO4-+16H++5C2O42-═2Mn2++10CO2↑+8H2O B.向氯化鐵溶液中通入過量二氧化硫:2Fe3++3SO2+6H2O═2Fe+3SO42-+12H+ C.銀和稀硝酸反應:3Ag+4H++NO3-═3Ag++2H2O+NO↑ D.向氯水中加入碳酸鈉:Cl2+CO32-═Cl-+ClO-+CO2↑ 組卷:11引用:3難度:0.7 -
 5.該裝置為鋰釩氧化物二次電池,其成本較低,對環境無污染:V2O5+xLiLixV2O5;在圖中用該電池電解含鎳酸性廢水可得到單質鎳(已知:Ni+2H+═Ni2++H2)。下列說法不正確的是( )放電充電
5.該裝置為鋰釩氧化物二次電池,其成本較低,對環境無污染:V2O5+xLiLixV2O5;在圖中用該電池電解含鎳酸性廢水可得到單質鎳(已知:Ni+2H+═Ni2++H2)。下列說法不正確的是( )放電充電A.該電池充電時,A電極的電極反應式為LixV2O5-xe-═V2O5+xLi+ B.電解過程中,b中NaCl溶液的物質的量濃度會增大 C.當鋰釩氧化物二次電池中有7gLi參與放電時,一定能得到29.35g鎳 D.鋰釩氧化物二次電池一般用非水溶液作為電解液 組卷:37引用:4難度:0.6 -
6.下列實驗裝置設計與對應結論正確的是( )
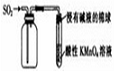


A收集SO2并驗證其漂白性 B構成原電池 C驗證非金屬性:Cl
>C>SiD在C右側可連接裝置
驗證CO2與Na2O2反應產物A.A B.B C.C D.D 組卷:5引用:3難度:0.5
二、非選擇題(本大題共5小題,共58分)
-
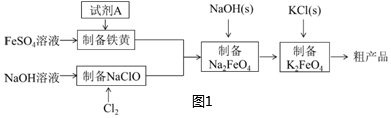
18.高鐵酸鉀(K2FeO4)是一種新型,高效的綠色水處理劑。工業上利用硫酸亞鐵為原料,通過鐵黃(FeOOH)制備高鐵酸鉀,可降低生產成本且產品質量優。工藝流程如圖1:
化學興趣小組的同學們在實驗室中,通過KClO溶液與Fe(NO3)3溶液的反應模擬工業生產制備高鐵酸鉀,圖2所示是模擬工業制備KClO溶液裝置。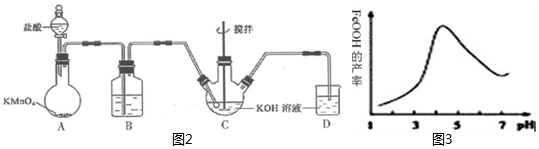
已知:K2FeO4可溶于水、微溶于濃KOH溶液;在強堿性溶液中比較穩定;在Fe3+催化作用下發生分解。
(1)工業流程中,需要加入試劑A制備鐵黃(FeOOH),最合適的試劑A是:。
A.Cl2
B.O2
C.KMnO4
D.HNO3
流程中制備鐵黃涉及到的離子反應方程式:。
實驗測得反應溶液的pH對鐵黃產率的影響如圖3所示,pH大于4.5時鐵黃產率逐漸降低的主要原因可能是:。
(2)根據工業流程推斷,溶解度K2FeO4Na2FeO4.(填“>”或“<”)
(3)實驗室使用KClO溶液和飽和Fe(NO3)3溶液制備高鐵酸鉀時,兩種試劑的滴加順序為。
(4)K2FeO4在水溶液中易水解,在“提純”K2FeO4中采用重結晶、洗滌、低溫烘干的方法,則洗滌劑最好選用溶液(填序號)
a.水
b.NH4Cl、異丙醇
c.Fe(NO3)3、異丙醇
d.異丙醇
(5)工業上用“間接碘量法”測定高鐵酸鉀的純度:用堿性KI溶液溶解1.00gK2FeO4樣品,調節pH使高鐵酸根全部被還原成亞鐵離子,再調節pH為3~4,用1.00mol/L的Na2S2O3標準溶液作為滴定劑進行滴定(2Na2S2O3+I2═Na2S4O6+2NaI),淀粉作指示劑,三次滴定,消耗Na2S2O3標準溶液分別17.98、18.02、18.95mL.原樣品中高鐵酸鉀的質量分數為。[M(K2FeO4)=198g/mol]組卷:34引用:3難度:0.5 -
19.某研究小組按下列路線合成藥物氨魯米特。
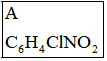 NC-CH2COOCH3K2CO3,DMF,120℃
NC-CH2COOCH3K2CO3,DMF,120℃ (CH3CH2)2SO4(CH3CH2)3N,90℃
(CH3CH2)2SO4(CH3CH2)3N,90℃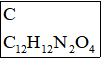 K2CO3,CH3OHH2O
K2CO3,CH3OHH2O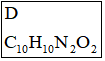 CH2=CHCOOCH3(CH3CH2)3N,CH3OH
CH2=CHCOOCH3(CH3CH2)3N,CH3OH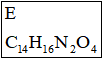 NaOH,H2O
NaOH,H2O 稀HClH2SO4,toluene△
稀HClH2SO4,toluene△ H2,Pd/C
H2,Pd/C
已知:
①A到B為取代反應,B的化學式為 C10H8N2O4,B到C是乙基化反應。
②C到D的反應包括水解、脫去羧基(CO2)兩步反應。
③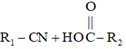 H2SO4,toluene△
H2SO4,toluene△
請回答:
(1)化合物A的結構簡式。
(2)下列說法不正確的是。
A.化合物B能發生加成反應
B.化合物C能發生消去反應
C.化合物G具有堿性且在酸性條件下能水解生成CO2
D.氨魯米特的分子式是C13H16N2O2
(3)設計化合物A轉變為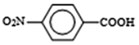 的合成路線(用流程圖表示,試劑任選) 。
的合成路線(用流程圖表示,試劑任選) 。
(4)寫出E→F的化學方程式。
(5)寫出化合物D可能的同分異構體的結構簡式,須同時符合:
②1H-NMR譜表明分子中有4種氫原子,IR譜顯示僅有苯環無其他環狀結構,含氨基-NH2;
②該物質能水解,且能發生銀鏡反應。組卷:2引用:1難度:0.4


