2021-2022學年黑龍江省哈爾濱三中高三(上)第三次質檢化學試卷
發布:2024/12/31 14:0:3
一、選擇題(每小題只有一個選項符合題意,1-10每題2分,11-20每題3分,共50分)
-
1.《新修本草》是藥圣李時珍《本草綱目》的修訂本,記載藥物844種,其中有關“青礬”的描述為:“本來綠色,新出窟未見風者,正如琉璃……燒之赤色……”,據此推測,“青礬”的主要成分及涉及的主要化學性質是( )
選項 主要成分 涉及主要化學性質 A ZnSO4?7H2O 加熱脫水生成ZnSO4 B Fe2(SO4)3?9H2O 加熱分解生成Fe2O3 C CuSO4?5H2O 加熱分解生成Cu2O D FeSO4?7H2O 加熱分解生成Fe2O3 A.A B.B C.C D.D 組卷:1引用:1難度:0.7 -
2.煤、石油、天然氣為人類生產生活提供能量,糖類、油脂、蛋白質是生命活動的物質和能量基礎,下列說法正確的是( )
A.煤的氣化、液化是化學變化 B.石油通過催化裂化得到的汽油不能使溴水褪色 C.蔗糖和淀粉的水解產物相同 D.蛋白質的水解產物是高級脂肪酸和甘油 組卷:43引用:2難度:0.8 -
3.對于給定的可逆反應,下列說法正確的是( )
①化學平衡正向移動,反應物的轉化率一定增大
②化學平衡正向移動,生成物的體積分數一定增大
③化學平衡正向移動,反應物的物質的量一定減少
④改變溫度,化學平衡一定會發生移動
⑤改變反應容器內壓強,化學平衡一定移動
⑥某反應物的轉化率增大,生成物的體積分數一定增大A.①④ B.②⑤ C.④⑥ D.④ 組卷:0引用:1難度:0.7 -
4.NA為阿伏加德羅常數的值,下列說法正確的是( )
A.1L 1mol/L CH3COOH溶液中含有NA個CH3COOH分子 B.標準狀況下,11.2L臭氧所含質子數為8NA C.0.2mol NO與0.1mol O2在密閉容器中充分反應后,容器中含有的氧原子數為0.4NA D.標準狀況下,2.24L CCl4中含有的C-Cl鍵數為0.4NA 組卷:29引用:3難度:0.6 -
5.在給定條件下,下列選項所示的物質間轉化均能實現的是( )
A.Cu CuOO2△CuSO4(aq)H2SO4(aq)B.SiO2 Na2SiO3(aq)NaOH(aq)Na2SO3(aq)過量SO2C.N2 NO放電O2HNO3(aq)H2OD.FeO FeCl3(aq)HCl(aq)無水FeCl3蒸干組卷:5引用:1難度:0.6 -
6.已知:C(s)+H2O(g)=CO(g)+H2(g)△H=akJ?mol-1;2C(s)+O2(g)=2CO(g)△H=一220kJ?mol-1;H-H、O=O和O-H鍵的鍵能分別為436、496和462kJ?mol-1,則a為( )
A.-332 B.+130 C.+332 D.-l30 組卷:194引用:10難度:0.9 -
7.常溫下向0.1mol/LHF溶液中加入少量水,下列各項增大的是( )
①pH
②c(H+) c(OH-)
③水的電離程度
④c(H+)-c(F-)
⑤c(H+)c(F-)A.①③⑤ B.①②④ C.①③ D.僅有① 組卷:1引用:2難度:0.6 -
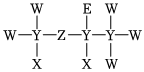 8.一種麻醉劑的分子結構式如圖所示。其中,X的原子核只有1個質子;元素Y、Z、W原子序數依次增大,且均位于X的下一周期;元素E的原子比W原子多8個電子。下列說法不正確的是( )
8.一種麻醉劑的分子結構式如圖所示。其中,X的原子核只有1個質子;元素Y、Z、W原子序數依次增大,且均位于X的下一周期;元素E的原子比W原子多8個電子。下列說法不正確的是( )A.XEZ4是一種強酸 B.非金屬性:W>Z>Y C.原子半徑:Y>W>E D.ZW2中,Z的化合價為+2價 組卷:981引用:10難度:0.5
二、非選擇題
-
23.草酸及其鹽是重要的化工原料,其中最常用的是三草酸合鐵酸鉀和草酸鈷,已知草酸鈷不溶于水,三草酸合鐵酸鉀晶體(K3[Fe(C2O4)3)]?3H2O)易溶于水,難溶于乙醇。這兩種草酸鹽受熱均可發生分解等反應,反應及氣體產物檢驗裝置如圖。
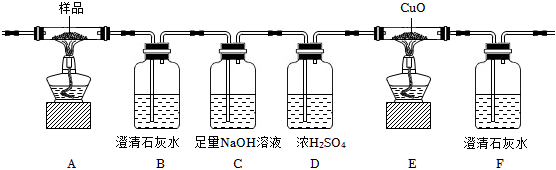
(l)草酸鈷晶體(CoC2O4?2H2O)在200℃左右可完全失去結晶水。用以上裝置在空氣中加熱5.49 g草酸鈷晶體(CoC2O4?2H2O)樣品,受熱過程中不同溫度范圍內分別得到一種固體物質,其質量如表。
實驗過程中觀察到只有B中澄清石灰水明顯變渾濁,E中始終沒有紅色固體生成。根據實驗結果,290-320℃過程中發生反應的化學方程式是溫度范圍/℃ 固體質量/g 150~210 4.41 290~320 2.41 890~920 2.25 ;設置D的作用是。
(2)用以上裝置加熱三草酸合鐵酸鉀晶體可發生分解反應。
①檢查裝置氣密性后,先通一段時間的N2,其目的是;結束實驗時,先熄滅酒精燈再通入N2至常溫。實驗過程中觀察到B、F中澄清石灰水都變渾濁,E中有紅色固體生成,則分解得到的氣體產物是。
②C的作用是。
(3)三草酸合鐵酸鉀的一種制備流程如圖: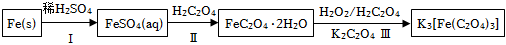
回答下列問題:
①流程“Ⅰ”硫酸必須過量的原因是
②流程中“Ⅲ”需控制溶液溫度不高于40℃,理由是;得到溶液后,加入乙醇,然后進行過濾。加入乙醇的理由是組卷:40引用:3難度:0.4 -
24.二氧化碳催化加氫合成乙烯是綜合利用CO2的熱點研究領域。回答下列問題:
(1)CO2催化加氫生成乙烯和水的反應方程式是。當反應達到平衡時,若增大壓強,則n(C2H4)。(填“變大”、“變小”或“不變”)
(2)理論計算表明,原料初始組成n(CO2):n(H2)=1:3,在體系壓強為0.1MPa,反應達到平衡時,四種組分的物質的量分數x隨溫度T的變化如圖所示。圖中,表示C2H4、CO2變化的曲線分別是、。CO2催化加氫合成C2H4反應的ΔH0。(填“大于”或“小于”)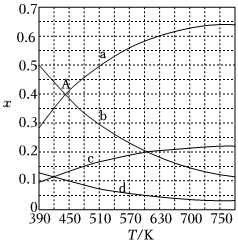
(3)根據圖中點A(440K,0.39),計算該溫度時反應的平衡常數Kp=(MPa)-3。(列出計算式。以分壓表示,分壓=總壓×物質的量分數)
(4)二氧化碳催化加氫合成乙烯反應往往伴隨副反應,生成C3H6、C3H8、C4H8等低碳經。一定溫度和壓強條件下,為了提高反應速率和乙烯選擇性,應當。組卷:23引用:2難度:0.3


