2021-2022學年河南省洛陽市偃師第一高級中學高三(上)段考化學試卷(三)
發布:2024/12/20 20:30:1
一、選擇題:本題共14小題,每小題3分,共42分。每小題只有一個選項符合題目要求。
-
1.化學與生產,生活密切相關。下列說法錯誤的是( )
A.石墨烯在電池、超級電容器和復合材料等方面有廣泛應用 B.由CH2=CHCN聚合而成的腈綸屬于有機高分子材料 C.抗擊新冠病毒的疫苗具有耐高溫、耐酸堿的性能 D.醫用軟膏中的凡士林、蠟筆中的石蠟的主要成分都屬于是烴 組卷:0引用:1難度:0.8 -
2.實驗室中下列做法合理的是( )
A.用P2O5干燥氨氣 B.用CCl4貯存金屬鈉 C.用酒精燈直接加熱坩堝 D.用稀氨水洗滌銀鏡反應后的試管 組卷:3引用:3難度:0.5 -
3.下列物質的性質與用途的對應關系錯誤的是( )
A.黃鐵礦FeS2具有還原性,工業上主要用于冶煉鐵 B.Cu2+具有毒性,CuSO4可用于配制波爾多液 C.Fe3+具有氧化性,FeCl3水溶液可用作H2S的脫除劑 D.硅膠固體多孔、表面積大,可以用作干燥劑或催化劑的載體 組卷:6引用:2難度:0.5 -
4.X、Y、Z、W是短周期主族元素,在核反應堆中發生反應:
Y+6an→10X+b1He、42W+14cn→10X+b1Z。下列說法正確的是( )d6A.3He和bX互為同位素 B.Z的氫化物的沸點一定低于W的 C.最高價氧化物對應水化物的酸性:W>Z D.XZW、(ZW)2分子中每個原子價層都達到了8電子穩定結構 組卷:5引用:2難度:0.7 -
5.除去括號中的雜質,下列除雜試劑選擇正確的是( )
選項 物質(雜質) 除雜試劑 A SO2(SO3) 飽和亞硫酸氫鈉溶液 B C2H4(SO2) 酸性KMnO4溶液 C NO2(CO2) NaOH溶液 D N2(CO) 熾熱的CuO粉末 A.A B.B C.C D.D 組卷:0引用:1難度:0.5 -
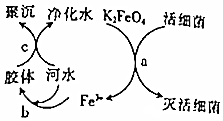 6.K2FeO4是高效、綠色的水處理劑,其原理如圖所示。下列說法正確的是( )
6.K2FeO4是高效、綠色的水處理劑,其原理如圖所示。下列說法正確的是( )A.步驟a中,細菌中的蛋白質發生了鹽析 B.膠體帶正電荷能與帶負電荷的雜質聚沉 C.整個過程中,只有步驟a發生了氧化還原反應 D.明礬的凈水原理與K2FeO4的相同 組卷:0引用:2難度:0.6
二、非選擇題:本題共4小題,共58分。
-
 17.氨是一種重要的工業品,也可作燃料電池的原料。回答下列問題:
17.氨是一種重要的工業品,也可作燃料電池的原料。回答下列問題:
(1)NH3的電子式為,Sb與N位于同一主族,核電荷數為51,其在元素周期表中的位置為。
(2)MichaelStoukides等利用BaZrO3基質子陶瓷膜反應器,通過電化學方法合成氨的裝置如圖所示。
①電解質溶液可能為(填“稀H2SO4”或“KOH”)溶液。
②有NH3生成的電極為該電池的(填“正極”或“負極”),負極的電極反應式為。
(3)N2H4(聯氨)可由NH3與NaClO溶液制得,該反應的離子方程式為。
(4)標準狀況下,將由16.8LN2和50.4LH2組成的混合氣體通入一體積為1L的恒容密閉容器中,在一定條件下發生反應:N2+3H2?2NH3。5min后反應達到平衡,此時容器壓強為起始壓強的,0~5min內υ(NH3)23mol?L?1?min?1,N2的轉化率為(保留3位有效數字)。組卷:5引用:2難度:0.7 -
18.硫酸銅可用作家禽養殖飼料的添加劑。一種以含砷氧化銅礦[含CuO、Cu(OH)2?CuCO3、砷的化合物及鉛的化合物]為原料制備飼料級硫酸銅的工藝流程如圖1所示。回答下列問題:
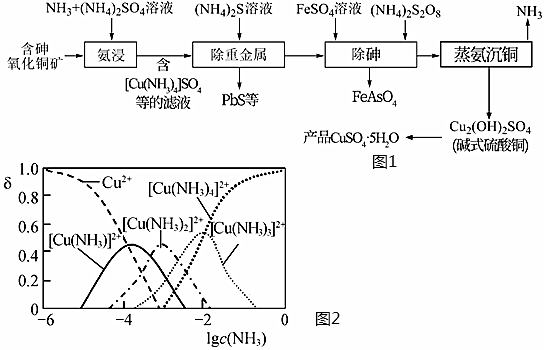
(1)“氨浸”時控制溫度為45℃,液固比為1:4,c(NH3)+c(NH4+)=1mol?L-1且c(NH3)=c(NH4+)。
①溫度不宜超過55℃,這是因為。
②“氨浸”時,Cu(OH)2?CuCO3轉化為[Cu(NH3)4]SO4和NH4HCO3的化學方程式為。
③溶液中Cu2+、[Cu(NH3)n]2+(n=1~4)的物質的量分數δ(x)與lgc(NH3)的關系如圖2所示。
lgc(NH3)=-3時,濃度最大的含銅微粒是,lgc(NH3)由-1→0時,發生反應的離子方程式為。
(2)“除砷”時控制pH=9,AsO33-最終轉化為FeAsO4沉淀,AsO43-中As的化合價為,該轉化過程中每生成1molFeAsO4,轉移mol電子。
(3)“蒸氨沉銅”的尾氣可返回工序循環使用,由堿式硫酸銅制取產品硫酸銅晶體的方法:將堿式硫酸銅先溶于硫酸,再、過濾、洗滌、干燥。組卷:8引用:3難度:0.6


