2021-2022學年甘肅省張掖二中高二(上)期末化學試卷
發布:2024/4/20 14:35:0
一、單選題(每個題只有一個選項,1-10每題2分,11-20每題2.5分,共45分)
-
1.下列廚房中的物質屬于強電解質的是( )
A.醋酸 B.白糖 C.淀粉 D.小蘇打 組卷:65引用:5難度:0.6 -
2.下列溶液一定顯酸性的是( )
A.含H+的溶液 B.c(OH-)<c(H+)的溶液 C.pH<7的溶液 D.水電離出的氫離子物質的量濃度為10-10mol/L 組卷:31引用:4難度:0.7 -
3.在1L0.1mol/LNH4Cl溶液中物質的量濃度最大的離子是( )
A.NH4+ B.Cl- C.H+ D.OH- 組卷:20引用:3難度:0.8 -
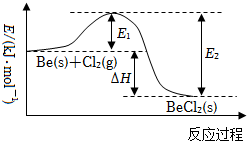 4.鈹和氯氣反應的能量變化如圖所示。下列說法正確的是( )
4.鈹和氯氣反應的能量變化如圖所示。下列說法正確的是( )A.E2是正反應的活化能 B.該反應的ΔH<0 C.加入催化劑,ΔH減小 D.ΔH=E2-E1 組卷:87引用:5難度:0.8 -
5.升高溫度,下列物理量不一定增大的是( )
A.化學平衡常數K B.水的離子積常數Kw C.化學反應速率v D.BaSO4的溶度積Ksp 組卷:26引用:2難度:0.5 -
6.下列表達式書寫正確的是( )
A.CaCO3的電離方程式:CaCO3=Ca2++ CO2-3B. 的電離方程式:HCO-3+H2O═H3O++HCO-3CO2-3C. 的水解方程式:CO2-3+2H2O═H2CO3+2OH-CO2-3D.CaCO3的沉淀溶解平衡表達式:CaCO3(s)=Ca2+(aq)+ (aq)CO2-3組卷:25引用:4難度:0.9 -
7.下列能用勒夏特列原理解釋的是( )
A.高溫及加入催化劑都能使合成氨的反應速率加快 B.紅棕色的NO2加壓后顏色先變深后變淺 C.SO2催化氧化成SO3的反應,往往需要使用催化劑 D.H2、I2、HI平衡時的混合氣體加壓后顏色變深 組卷:73引用:13難度:0.7 -
8.常溫下,下列溶液中各組離子一定能大量共存的是( )
A.使甲基橙紅色的溶液:Na+、AlO2-、NO3-、CO32- B.由水電離產生的c(H+)=1×10-12mol?L-1的溶液:K+、SO42-、HCO3-、Cl- C. =0.1mol?L-1的溶液:Na+、K+、CO32-、NO3-Kwc(H+)D.pH=8的溶液中,Na+、Fe3+、CO32-、Cl- 組卷:9引用:3難度:0.7
二、填空題
-
23.電解質的水溶液中存在電離平衡。
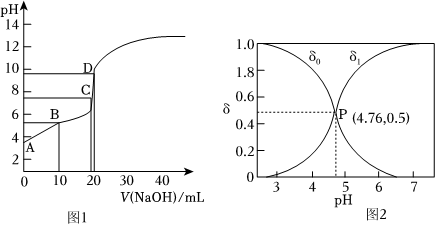
(1)醋酸是常見的弱酸。
①醋酸在水溶液中的電離方程式為。
②下列方法中,可以使醋酸稀溶液中CH3COOH電離程度增大的是(填字母序號)。
a.滴加少量濃鹽酸
b.微熱溶液
c.加水稀釋
d.加入少量醋酸鈉晶體
(2)實驗室現有醋酸鈉固體,取少量溶于水,溶液呈(選填“酸性”、“中性”或“堿性”),其原因是(用離子方程式表示)。
(3)常溫下,用0.1000mol?L-1NaOH溶液滴定20.00mL0.1000mol?L-1CH3COOH溶液。
①B點和D點的溶質分別是,。
②圖1中A、B、C、D四點各點對應的溶液中水的電離程度大小順序是。
(4)常溫下,醋酸水溶液中含碳微粒的分布分數(平衡時某微粒的濃度占各含碳微粒總濃度的分數)與pH的關系如圖2。
①常溫下,CH3COOH的電離常數約為。
②當c(CH3COOH):C(CH3COO-)=4:1的混合溶液,pH≈。組卷:26引用:1難度:0.6 -
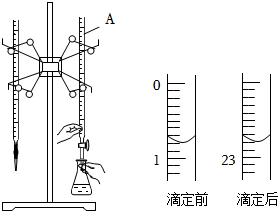 24.如圖是用0.1000mol/L的鹽酸滴定某未知濃度的NaOH溶液的示意圖和某次滴定前、后的盛放鹽酸滴定管中液面的位置。請回答:
24.如圖是用0.1000mol/L的鹽酸滴定某未知濃度的NaOH溶液的示意圖和某次滴定前、后的盛放鹽酸滴定管中液面的位置。請回答:
(1)儀器A的名稱是;
(2)鹽酸的體積讀數:滴定前讀數為mL,滴定后讀數為mL;
(3)某實驗小組同學的三次實驗的實驗數據如下表所示。根據表中數據計算出的待測NaOH溶液的濃度是mol?L-1(保留四位有效數字);
(4)滴定操作可分解為如下幾步(所用的儀器剛用蒸餾水洗凈):實驗編號 待測NaOH溶液的體積(mL) 滴定前鹽酸的體積讀數(mL) 滴定后鹽酸的體積讀數(mL) 1 20.00 1.20 23.22 2 20.00 2.21 24.21 3 20.00 1.50 23.48
A用堿式滴定管向錐形瓶里注入20.00mL待測NaOH溶液,并加入2~3滴酚酞;
B.用標準溶液潤洗酸式滴定管2~3次;
C.把盛有標準溶液的酸式滴定管固定好,調節滴定管尖嘴使之充滿溶液,使管內無氣泡;
D.取標準鹽酸注入酸式滴定管至刻度0以上2~3cm;
E.調節液面至0或0以下刻度,記下讀數;
F.把錐形瓶放在滴定管的下面,用標準鹽酸滴定至終點并記下滴定管液面的刻度。
最佳的操作步驟的順序是(用序號字母填寫)。
(5)判斷到達滴定終點的實驗現象是。
(6)對下列幾種假定情況進行討論:“偏低”的是。
①裝標準液的滴定管,滴定前管尖端有氣泡,滴定后氣泡消失
②取待測液的滴定管,滴定前管尖端沒有氣泡,滴定后有氣泡
③若滴定前錐形瓶未用待測液潤洗
④標準液讀數時,若滴定前仰視,滴定后俯視組卷:59引用:1難度:0.6


