2021-2022學年湖南省名校聯盟高一(下)月考化學試卷(3月份)
發布:2024/12/21 10:30:2
一、選擇題:本題共10小題,每小題3分,共30分。在每小題列出的四個選項中,只有一項符合題目要求。
-
1.北京冬奧會上科技元素“星光熠熠”,向世界展現了一個現代化的中國。212項技術在冬奧會上得以應用,如含有石墨烯的智能服飾、鋁合金管材、碳纖維和光導纖維等等。下列有關說法中,不正確的是( )
A.石墨烯是熱導率高的碳納米材料 B.鋁合金是密度較小的金屬材料 C.碳纖維主要成分是耐低溫的無機非金屬材料 D.光導纖維是硅酸鹽材料 組卷:12引用:1難度:0.7 -
2.我國科研團隊首次制備出以肖特基結作為發射結的垂直結構的硅-石墨烯-鍺高速晶體管,代表我國在這一尖端科技領域走在了世界的前列。下列有關鍺(Ge-IVA)的說法錯誤的是( )
A.鍺元素與碳元素處于同一主族 B. Ge和7332Ge互為同素異形體7532C. Ge的中子數為427432D.鍺與硅一樣可用作半導體材料 組卷:34引用:2難度:0.6 -
3.在溶液中能大量共存的離子組是( )
A.NH4+、CO32-、K+、OH- B.Fe2+、H+、Cl-、MnO4- C.H+、Na+、ClO-、SO42- D.SO42-、Na+、CO32-、K+ 組卷:4引用:1難度:0.7 -
4.用NA表示阿伏加德羅常數的值,下列說法中不正確的是( )
A.4.4g超重水(T2O)中所含質子數為2NA B.在標準狀況下,2.24LH2O2共價鍵數為0.3NA C.200mL18.4mol/L濃硫酸與足量銅反應,生成的SO2分子總數小于1.84NA D.0.2molNa2O2和Na2O的混合物中含有離子總數為0.6NA 組卷:1引用:1難度:0.5 -
5.下列化學用語不正確的是( )
A.Na+的結構示意圖: 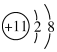
B.H2O的分子結構模型: 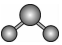
C.HClO的結構式:H-O-Cl D.用電子式表示HCl的形成過程:  組卷:6引用:3難度:0.7
組卷:6引用:3難度:0.7 -
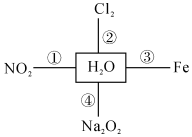 6.水是一種重要的資源,圖中和水相連的物質都能和水反應,下列說法正確的是( )
6.水是一種重要的資源,圖中和水相連的物質都能和水反應,下列說法正確的是( )A.①反應,NO2與水反應,氧化劑與還原劑的物質的量之比為1:2 B.②反應,離子方程式為Cl2+H2O═2H++Cl-+ClO- C.③反應,生成Fe2O3和H2 D.④反應,1molNa2O2與足量水反應,放出11.2LO2 組卷:9引用:2難度:0.6
三、非選擇題:本題共4大題,共54分。
-
17.二氧化氯(ClO2)是一種黃綠色有刺激性氣味的氣體,與Cl2的氧化性相近,可用于自來水消毒。為檢測二氧化氯能否與KI溶液反應,某興趣小組設計了如圖實驗(實驗裝置如圖所示,且氣密性良好,D中穩定劑不能與Cl2反應)。回答下列問題:

(1)打開B的活塞,A中發生反應,且產物有ClO2、Cl2等,該反應的化學方程式為。
(2)關閉B的活塞,ClO2在D中被穩定劑完全吸收生成NaClO2,此時觀察到F中溶液的顏色不變,則裝置C的作用是。
(3)已知在酸性條件下NaClO2可發生反應生成NaCl并放出ClO2,反應的離子方程式為。打開E的活塞,D中發生反應,觀察到裝置F中的溶液變成藍色,則F的反應中氫化劑與還原劑的物質的量之比為。
(4)自來水廠用碘量法檢測水中ClO2的濃度,其實驗操作如下:取300.0mL的水樣,酸化,加入足量的碘化鉀反應,再用0.2000mol?L-1Na2S2O3溶液和生成的碘單質反應(反應的化學方程式為:I2+2S2═2I-+S4O2-3),恰好完全反應時用去25.00mLNa2S2O3溶液,測得該水樣中的ClO2含量為O2-6mg?L-1。
(5)該小組同學還制得了ClO2的水溶液,以探究FeI2的還原性。他們進行了如下實驗:取一定量的FeI2溶液,向其中滴加少量ClO2的水溶液,振蕩后溶液呈黃色,某同學對產生黃色的原因提出了如下假設:
假設1:Fe2+被ClO2氧化;
假設2:I-被ClO2氧化。
為驗證假設1,請你完成下表。實驗步驟 預期現象 結論 取少量黃色溶液于試管中,滴加幾滴 假設1正確 組卷:13引用:1難度:0.4 -
18.氮元素形成的化合物種類十分豐富。請根據如圖工業制硝酸的原理示意圖回答含氮化合物相關的問題:
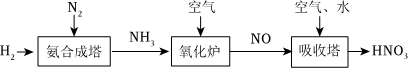
(1)在氨合成塔中發生的氧化還原反應中,N2是(填“氧化劑”或“還原劑”)。
(2)在加熱和催化劑作用下氧化爐中的產物為NO和水,寫出該反應的化學方程式。
(3)用NaClO溶液吸收硝酸尾氣,可提高尾氣中NO的去除率。其它條件相同,NO轉化為的轉化率隨NaClO溶液初始pH(用稀鹽酸調節)的變化如圖所示。NO-3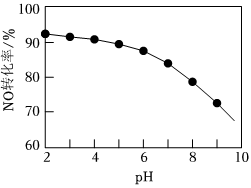
①在酸性NaClO溶液中,HClO氧化NO生成Cl-和,其離子方程式為NO-3。
②NaClO溶液的初始pH越小,NO轉化率越高,其原因是。
(4)“吸收塔”尾部會有含NO、NO2等氮氧化物的尾氣排出,為消除它們對環境的破壞作用,目前應用最廣泛的煙氣氮氧化物脫除技術是NH3催化還原氮氧化物(SCR)技術。反應原理如圖所示: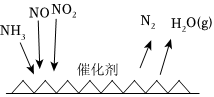
當NO2與NO的物質的量之比為1:1時,與足量氨氣在一定條件下發生反應。當有18mol電子發生轉移時,則生成N2的物質的量為。
(5)某實驗小組用足量銅與一定量濃硝酸反應,得到硝酸銅溶液和NO2、N2O4、NO的混合氣體,這些氣體與1.12LO2(標準狀況)混合后通入水中,所得氣體完全被水吸收生成硝酸。若向所得硝酸銅溶液中加入2mol?L-1NaOH溶液至Cu2+恰好完全沉淀,則消耗NaOH溶液的體積是mL。組卷:68引用:3難度:0.7


