2018-2019學年廣東省第二師范學院番禺附中高二(上)期中化學試卷
發布:2024/4/20 14:35:0
一、選擇題(本大題共20小題,每題3分,共60分)
-
1.能源問題是人類生存和社會發展的重要問題,下列關于能源問題的說法正確的是( )
A.氫氣是具有熱值高、無污染等優點的燃料 B.石油作為重要的可再生能源應該被盡量地利用 C.煤燃燒是化學能只轉化為熱能的過程 D.風能是太陽能的一種轉換形式,所以風能屬于二次能源 組卷:9引用:1難度:0.3 -
2.下列不屬于電離方程式的是( )
A.2H2O?H3O++OH- B.H2O?H++OH- C.CH3COOH+H2O?CH3COO-+H3O+ D.CH3COOH+NaOH=CH3COONa+H2O 組卷:19引用:1難度:0.3 -
3.氫氟酸是弱酸,電離方程式為HF=H++F-,達到電離平衡的標志是( )
A.c(H+)=c(F-) B.v(電離)=v(形成分子) C.溶液顯酸性 D.單位時間內,電離的HF分子數與生成的F-數相等 組卷:38引用:6難度:0.7 -
4.在溶液的導電性實驗裝置里,分別注入20ml 4mol/L的醋酸和20ml 4mol/L的氨水,燈光明暗程度相似,如果把這兩種溶液混合后再試驗,則( )
A.燈光明暗程度不變 B.燈光變暗 C.燈光變亮 D.燈光明暗程度變化不明顯 組卷:182引用:7難度:0.7 -
5.下列反應既屬于氧化還原反應,又屬于放熱反應的是( )
A.灼熱的木炭與CO2反應 B.鋅粒和稀硫酸反應 C.氫氧化鈉溶液與稀硫酸反應 D.Ba(OH)2?8H2O晶體與NH4Cl晶體的反應 組卷:3引用:1難度:0.5 -
6.已知反應:①101kPa時,2C(s)+O2(g)═2CO(g)△H=-221kJ/mol
②稀溶液中,H+(aq)+OH-(aq)═H2O(l)△H=-57.3kJ/mol
下列結論正確的是( )A.碳的燃燒熱等于110.5kJ/mol B.①的反應熱為221kJ/mol C.稀硫酸與稀NaOH溶液反應的中和熱△H為-57.3kJ/mol D.稀醋酸與稀NaOH溶液反應生成1mol水,放出57.3kJ熱量 組卷:7引用:6難度:0.5 -
7.下列依據熱化學方程式得出的結論正確的是( )
A.已知2SO2(g)+O2(g)?2SO3(g)為放熱反應,則SO2的能量一定高于SO3的能量 B.已知C(石墨,s)=C(金剛石,s)△H>0,則金剛石比石墨穩定 C.已知CH3CH2OH(g)+H2O(g)?4H2(g)+2CO(g)△H=+256.6kJ?mol-1,升高反應溫度,乙醇的轉化率增大 D.已知2C(s)+2O2(g)═2CO2(g)△H1,2C(s)+O2(g)═2CO(g)△H2,則△H1>△H2 組卷:1引用:1難度:0.5 -
8.不管化學過程是一步完成或分為數步完成,這個過程的熱效應是相同的已知
H2O(g)=H2O(l)△H1=Q1kJ?mol-1
C2H5OH(g)=C2H5OH(l)△H2=Q2 kJ?mol-1
C2H5OH(g)+3O2(g)=2CO2(g)+3H2O(g)△H3=Q3kJ?mol-1
若使23g酒精液體完全燃燒,最后恢復到室溫,則放出的熱量為( )A.Q1+Q2+Q3 B.0.5(Q1+Q2+Q3) C.0.5Q1-1.5Q2+0.5Q3 D.-1.5Q1+0.5Q2-0.5Q3 組卷:196引用:10難度:0.7
二、非選擇題(本大題共6小題,共40分)
-
25.在某一容積為2L的密閉容器中,加入0.6mol NH3,在一定條件下發生如下反應:2NH3(g)?N2(g)+3H2(g)ΔH=+93kJ/mol,反應中NH3的變化如圖1所示。
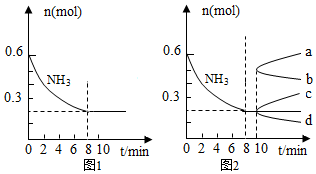
(1)在圖1上作出H2的變化曲線。
(2)根據如圖1數據,反應開始至達到平衡時,平均速率v(N2)為。
(3)升高溫度,容器中氣體的平均相對分子質量將。(填“增大”“減少”或“不變”)
(4)如圖2所示,第10分鐘時,若把容器壓縮為1L,則NH3的變化曲線為。(填字母)組卷:0引用:1難度:0.5 -
26.研究NO2、NO、SO2、CO等大氣污染氣體的處理具有重要意義。
(1)溫度為T、容積為10L的恒容密閉容器中,充入1molCO和0.5molSO2發生反應:2CO(g)+SO2(g)?2CO2(g)+S(g)實驗測得生成的CO2體積分數(φ)隨著時間的變化曲線如圖所示: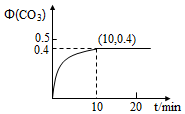
①達到平衡狀態時,SO2的轉化率為,該溫度下反應的平衡常數K=。
②其它條件保持不變,再向上述平衡體系中充入SO2(g)、CO(g)、S(g)、CO2(g)各0.2mol,此時v(正)v(逆)(填“>”“<”或“=”)。
(2)SCR法是工業上消除氦氧化物的常用方法,反應原理為4NH3(g)+4NO(g)+O2(g)?4N2(g)+6H2O(g)△H<0.在催化劑作用下,NO轉化率與溫度的關系如圖所示: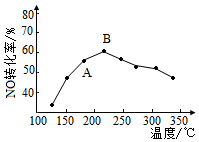
圖中A點處NO的轉化率(填“可能是”、“一定是”或“一定不是”)該溫度下的平衡轉化率;B點之后,NO轉化率降低的原因可能是。
A.平衡常數變大
B.副反應增多
C.催化劑活性降低
D.反應活化能增大
(3)2SO2(g)+O2(g)?2SO3(g)△H=-198kJ.jye.ai-l是制備硫酸的重要反應。在VL恒容密閉容器中充入2molSO2和1molO2,在不同條件下進行反應,反應體系總壓強隨時間的變化如圖所示。a和b平衡時,SO3體積分數較大的是。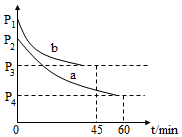 組卷:1引用:1難度:0.5
組卷:1引用:1難度:0.5


