2022年貴州省遵義市匯川區(qū)中考化學(xué)四模試卷
發(fā)布:2024/4/20 14:35:0
一、選擇題(本大題包括10個(gè)小題,每小題2分,共20分。每小題只有一個(gè)正確答案,請(qǐng)?jiān)诖痤}卡選擇題欄內(nèi)用2B鉛筆將對(duì)應(yīng)題目答案的標(biāo)號(hào)涂黑。)
-
1.為了預(yù)防侏儒癥,人體需要攝入的元素是( )
A.鋅 B.氟 C.鈣 D.鐵 組卷:257引用:3難度:0.8 -
2.下列是火柴頭中含有的四種物質(zhì),火柴點(diǎn)燃時(shí)會(huì)生成刺激性氣味的氣體,已知這種氣體會(huì)污染空氣,生成這種有害物質(zhì)的是( )
A.二氧化錳 B.氯酸鉀 C.紅磷 D.硫 組卷:146引用:10難度:0.5 -
3.用氯化鈉固體配制50g質(zhì)量分?jǐn)?shù)為6%的溶液,不需要用到的儀器是( )
A. 
B. 
C. 
D.  組卷:284引用:7難度:0.6
組卷:284引用:7難度:0.6 -
4.下列物質(zhì)的用途中既利用物理性質(zhì)又利用化學(xué)性質(zhì)的是( )
A.金剛石做鉆石 B.氮?dú)庾鞅Wo(hù)氣 C.二氧化碳滅火 D.小蘇打治療胃酸過多 組卷:37引用:2難度:0.2 -
5.“莊稼一枝花,要靠肥當(dāng)家”。化學(xué)肥料與傳統(tǒng)農(nóng)家肥配合使用,對(duì)促進(jìn)農(nóng)作物增產(chǎn)、解決糧食短缺問題起了重要作用。下列肥料中要避免與草木灰混合使用的是( )
A.CaH2PO4 B.KNO3 C.CO(NH2)2 D.NH4NO3 組卷:61引用:2難度:0.8
二、非選擇題(本大題包括7個(gè)小題,每空1分,共40分。請(qǐng)將下列各題應(yīng)答內(nèi)容,填寫到答題卡相應(yīng)題號(hào)的空格內(nèi)。)
-
16.金屬在生產(chǎn)、生活和社會(huì)發(fā)展中應(yīng)用較為廣泛,中國制造,讓世界矚目!
(1)航天:我國用長(zhǎng)征三號(hào)乙運(yùn)載火箭成功發(fā)射第55顆北斗導(dǎo)航衛(wèi)星,化學(xué)材料在其中起到了重要作用,鋁合金和鈦合金被廣泛用于航天工業(yè)、一般情況下,航天工業(yè)使用鋁合金的優(yōu)點(diǎn)是(填一點(diǎn)即可)。
(2)冶煉:我國濕法煉銅很早就有記載,東漢《神農(nóng)本草經(jīng)》曾記載石膽“能化鐵為銅”。向硝酸亞鐵和硝酸銀的混合溶液中加入一定量的鎂粉,充分反應(yīng)后過濾,濾液呈淺綠色,則濾出的濾液中一定含有的金屬離子是。
(3)應(yīng)用:在鋼中加入不同的合金元素可以提高其性能,例如,加入鎢可以增強(qiáng)合金鋼的耐磨性等。用黑鎢礦制備鎢的過程如圖所示:(注:鎢酸是難溶于水的黃色固體,高溫可分解。)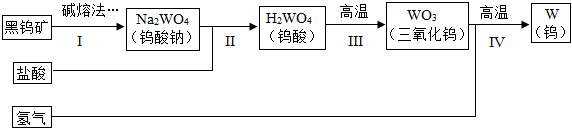
①寫出步驟IⅡ中的化學(xué)方程式;
②步驟IV中冶煉a噸鎢實(shí)際上需要?dú)錃獾馁|(zhì)量b為(用字母表示)。組卷:46引用:2難度:0.7 -
17.鐵銨[NH4Fe(SO4)2]常用于檢驗(yàn)溶液中的硫氰根(SCN﹣)。含有硫氰根的化合物可稱為硫氰化物。其反應(yīng)原理是:鐵離子與硫氰根結(jié)合生成Fe(SCN)3而使溶液顯示特殊的紅色。
(1)實(shí)驗(yàn)室制備硫酸鐵銨的原料是:鐵、硫酸、雙氧水和硫酸銨。制備過程如下:
①一定溫度下,將一定量的鐵粉與過量硫酸混合,并不斷攪拌。
②往上述得到的混合溶液中緩慢加入5%H2O2溶液,此時(shí)溶液中的鐵元素的化合價(jià)會(huì)發(fā)生改變,溶液由淺綠色變成色。實(shí)驗(yàn)時(shí)配制500g5%的H2O2溶液需30%H2O2溶液g(保留小數(shù)點(diǎn)后一位)。
③繼續(xù)加入一定量的固體(NH4)2SO4充分混合,然后經(jīng)過蒸發(fā)、冷卻、結(jié)晶、過濾等操作,即可得到硫酸鐵銨[NH4Fe(SO4)2]產(chǎn)品。
(2)根據(jù)硫酸鐵銨[NH4Fe(SO4)2]的組成特點(diǎn),請(qǐng)預(yù)測(cè)其化學(xué)性質(zhì),說明預(yù)測(cè)的依據(jù),并設(shè)計(jì)實(shí)驗(yàn)方案進(jìn)行驗(yàn)證。限選試劑是:NH4Fe(SO4)2溶液、KSCN溶液、酚酞溶液、NaOH溶液、BaCl2溶液、稀鹽酸、銅片。預(yù)測(cè) 預(yù)測(cè)的依據(jù) 驗(yàn)證預(yù)測(cè)的實(shí)驗(yàn)操作與預(yù)期現(xiàn)象 ①能夠與堿反應(yīng) [NH4Fe(SO4)2]含 ,屬于銨鹽,與堿反應(yīng)放出氨氣。NH+4取少量[NH4Fe(SO4)2]溶液于試管中, ,如果觀察到有刺激性氣味的氣泡產(chǎn)生,則預(yù)測(cè)成立。②能夠與 (填物質(zhì)類別)反應(yīng)取少量[NH4Fe(SO4)2]溶液于試管中, ,如果觀察到,則預(yù)測(cè)成立。組卷:13引用:2難度:0.5


