2020-2021學年湖北省武漢外國語學校高一(下)期末化學試卷
發布:2025/1/6 5:0:2
一、單項選擇題(每題3分,共45分)
-
1.下列有關說法正確的是( )
A.煤的干餾,石油的分餾等物理變化,是綜合利用煤和石油的途徑 B.糖類、油脂、蛋白質都屬于天然高分子化合物 C.亞硝酸鈉具有一定毒性,還會與食物作用生成致癌物,因此不可用作食品添加劑 D.按照綠色化學的原則,xCH2=CH2+yO2→ 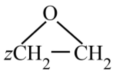 (式中的系數x,y,z均為整數),則(x+y+z)的最小數值為5組卷:8引用:1難度:0.9
(式中的系數x,y,z均為整數),則(x+y+z)的最小數值為5組卷:8引用:1難度:0.9 -
2.下列各項表達中正確的是( )
A.-CH3(甲基) 的電子式為 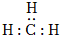
B.CCl4分子的空間充填模型: 
C.光氣COCl2的結構式: 
D.阿司匹林的分子式: 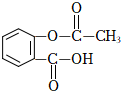 組卷:7引用:1難度:0.7
組卷:7引用:1難度:0.7 -
3.下列指定反應的離子方程式正確的是( )
A.室溫下用稀NaOH溶液吸收Cl2:Cl2+2OH-═ClO-+Cl-+H2O B.用鋁粉和NaOH溶液反應制取少量H2:Al+2OH-═AlO2-+H2↑ C.室溫下用稀HNO3溶解銅:Cu+2NO3-+2H+═Cu2++2NO2↑+H2O D.向Na2SiO3溶液中滴加稀鹽酸:Na2SiO3+2H+═H2SiO3↓+2Na+ 組卷:1477引用:16難度:0.5 -
4.下列說法正確的是( )
A.某有機物燃燒只生成CO2和H2O,且二者物質的量相等,則有機物的組成為一定CnH2n B.相同物質的量的烴,完全燃燒,生成的CO2越多,說明烴中的碳的百分含量越大 C.氣態烴CxHy在O2充分燃燒,反應前后氣體體積不變(溫度>100℃),則y=4 D.相同質量的烴,完全燃燒,消耗O2越多,烴中碳的百分含量越高 組卷:16引用:2難度:0.9 -
5.下列實驗操作和現象以及對應的結論正確的是( )
操作和現象 結論 A 向汽油和地溝油中分別加入足量的NaOH溶液并加熱,現象不同 可鑒別出地溝油 B 分別向雞蛋清水溶液中加入飽和硫酸銨溶液和硫酸銅溶液,均產生沉淀 蛋白質遇鹽變性 C 加熱乙醇與濃硫酸的混合溶液,將產生的氣體通入少量酸性KMnO4溶液,溶液紫紅色褪去 有乙烯生成 D 向蔗糖溶液中加入稀硫酸,水浴加熱一段時間,再加入新制Cu (OH)2懸濁液,用酒精燈加熱,未見磚紅色沉淀 蔗糖未水解 A.A B.B C.C D.D 組卷:4引用:1難度:0.6 -
6.用下列實驗裝置進行實驗,能達到實驗目的的是( )
A B C D 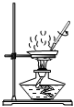
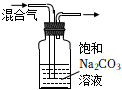
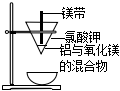
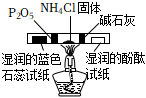
從膽礬晶體中獲得無水硫酸銅 除去CO2氣體中
混有的SO2冶煉金屬鎂 檢驗NH4Cl受熱分解產生的兩種氣體 A.A B.B C.C D.D 組卷:9引用:1難度:0.7
二、非選擇題(55分)
-
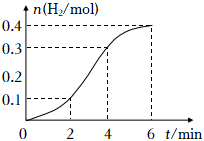 18.氫氣是未來理想的能源。
18.氫氣是未來理想的能源。
(1)實驗室用鐵與2mol?L-1的硫酸反應生成H的物質的量與反應時間的關系如圖所示。按要求回答下列問題。
①產生H2的平均反應速率最大的時間段是(填“0~2min”“2~4min”或“4~6min“),該時間段內對反應速率起關鍵作用的影響因素是。
②若向體系中加入少量硫酸銅溶液,可以加快氫氣的生成速率,其原因是。
③對于反應:C(s)+H2O(g)CO(g)+H2(g)。一定溫度下,在恒容密閉容器中進行該反應,下列敘述能說明該反應達到平衡的是△(填序號)
a.v正(H2)=v正(H2O)
b.斷裂1molH-H鍵的同時斷裂1molH-O鍵
c.容器內氣體的壓強不變
d.容器內氣體平均相對分子質量不變
e.容器內氣體的密度不變
f.H2O(g)、CO(g) 和H2(g)的物質的量濃度相等
(2)工業上用海水制氫氣的新技術的原理為2H2O2H2↑+O2↑。回答下列問題:激光TiO2
①分解海水的反應屬于反應(填“放熱”或“吸熱”)。
②分解產生的氫氣儲存比較困難,有一種儲存方法的原理可表示為:
NaHCO3+H2HCOONa+H2O。下列說法正確的是儲氫釋氫(填序號)。
A.儲氫、釋氫過程中均有能量變化
B.儲氫時反應物中只有離子鍵、非極性鍵的斷裂
C.儲氫過程中,NaHCO3被還原
D.釋氫過程中,每消耗0.1molH2O放出2.24L H2
(3)甲烷燃料電池采用鉑作電極催化劑,電池中的質子交換膜只允許質子(H+)和水分子通過。其工作原理的示意圖如圖,請回答下列問題: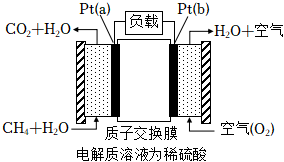
①Pt(a)電極是電池的極,電極反應式為。
②電解質溶液中的H+向(填“a”或“b“)極移動,電子流入的電極是(填“a”或“b“)極。
③該電池工作時消耗11.2LCH4(標準狀況下),則電路中通過mol電子。組卷:33引用:1難度:0.4 -
19.W是由A、B兩種元素組成的AB2型化合物。
(1)若W和焦炭在高溫下發生反應,所制得的半導體材料應用廣泛。寫出該反應化學方程式。
(2)若取兩支試管分別加入少量W溶液,往一支試管中滴入KSCN溶液,無明顯現象。往另一支試管中加入足量新制氯水,再加入適量CCl4,振蕩,靜置,下層溶液呈紫紅色;往上層溶液中滴入KSCN溶液,溶液呈紅色。
①W溶液中所含金屬陽離子為。
②上述實驗中,W與足量新制氯水反應的離子方程式為。
(3)若A、B是同主族元素,W溶于水生成一種二元弱酸。
①B在元素周期表中的位置為。
②如果常溫下W為氣體,寫出將W氣體通入足量Ba(NO3)2溶液中發生的反應的化學方程式。
(4)若W是離子化合物,其陰、陽離子均含18個電子,且陰、陽離子個數比為1:1。
①陰離子的電子式為。
②1mol W與足量水充分反應,轉移電子的物質的量為mol。組卷:9引用:1難度:0.5


