2022-2023學年廣西欽州四中高二(上)期中化學試卷
發布:2024/10/20 2:0:1
一、單選題(25×2=50)
-
1.一定溫度下,在5L的恒容密閉容器中發生反應N2(g)+3H2(g)?2NH3(g)。反應過程中的部分數據如表所示,下列說法正確的是( )
n/mol
t/min
n(N2)
n(H2)
n(NH3)0 a 24 0 5 13 6 10 12 15 8 A.N2的初始濃度為16mol?L-1 B.0~5min用H2表示的平均反應速率為0.24mol?L-1?min-1 C.平衡狀態時,c(N2)=2.6mol?L-1 D.N2的平衡轉化率為25% 組卷:39引用:3難度:0.5 -
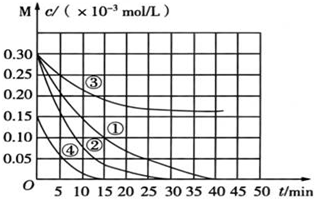 2.用Na2FeO4溶液氧化廢水中的還原性污染物M,為研究降解效果設計如下對比實驗探究溫度、濃度、pH、催化劑對降解速率和效果的影響,實驗測得M的濃度與時間關系如圖所示。
2.用Na2FeO4溶液氧化廢水中的還原性污染物M,為研究降解效果設計如下對比實驗探究溫度、濃度、pH、催化劑對降解速率和效果的影響,實驗測得M的濃度與時間關系如圖所示。
下列說法不正確的是( )實驗編號 溫度/℃ pH ① 25 1 ② 45 1 ③ 25 7 ④ 25 1 A.實驗①在15min內M的降解速率為1.33×10-5mol/(L?min) B.若其他條件相同,實驗①②說明升高溫度,M降解速率增大 C.若其他條件相同,實驗①③證明pH越高,越不利于M的降解 D.實驗①④說明M的濃度越小,降解的速率越快 組卷:4引用:1難度:0.5 -
3.900℃時,向2.0L恒容密閉容器中充入0.40mol乙苯,發生反應:
一段時間后,反應達到平衡,反應過程中測定的部分數據如表所示,下列說法正確的是( )時間/min 0 10 20 30 40 n(乙苯)/mol 0.40 0.30 0.24 n2 n3 n(苯乙烯)/mol 0.00 0.10 n1 0.20 0.20 A.保持其他條件不變,向容器中充入不參與反應的水蒸氣作為稀釋劑,則乙苯的轉化率大于50.0% B.反應在前20min內的平均反應速率v(H2)=0.008mol?L-1?min-1 C.保持其他條件不變,向容器中充入不參與反應的水蒸氣作為稀釋劑,體系的總壓增大,平衡時苯乙烷的分壓也增加 D.相同溫度下,起始時向容器中充入0.10mol乙苯、0.10mol苯乙烯和0.30mol H2,則達到平衡前:v正<v逆 組卷:32引用:3難度:0.5 -
 4.已知反應X(g)+3Y(g)?2Z(g)ΔH的能量變化如圖所示。下列說法正確的是( )
4.已知反應X(g)+3Y(g)?2Z(g)ΔH的能量變化如圖所示。下列說法正確的是( )A.ΔH=E2-E1 B.更換高效催化劑,E3不變 C.恒壓下充入一定量的氦氣n(Z)減小 D.壓縮容器,c(X)減小 組卷:56引用:10難度:0.7 -
5.關于一定條件下的化學平衡H2(g)+I2(g)?2HI(g)△H<0,下列說法正確的是( )
A.恒溫恒容,充入H2,v(正)增大,平衡右移 B.恒溫恒容,充入He,v(正)增大,平衡右移 C.加壓,v(正),v(逆)不變,平衡不移動 D.升溫,v(正)減小,v(逆)增大,平衡左移 組卷:204引用:12難度:0.5 -
6.我國科學家實現了在銅催化劑條件下將DMF[(CH3)2NCHO]轉化為三甲胺[N(CH3)3].計算機模擬單個DMF分子在銅催化劑表面的反應歷程如圖所示,下列說法正確的是( )
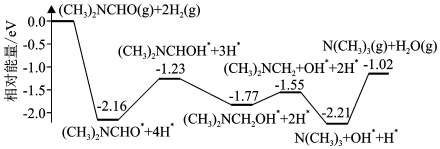
A.該歷程中最小能壘的化學方程式為(CH3)2NCH2OH*═(CH3)2NCH2+OH* B.該歷程中最大能壘(活化能)為2.16eV C.該反應的熱化學方程式為(CH3)2NCHO(g)+2H2(g)═N(CH3)3(g)+H2O(g)△H=-1.02ev?mol-1 D.增大壓強或升高溫度均能加快反應速率,并增大DMF平衡轉化率 組卷:101引用:9難度:0.6 -
7.對于反應:4CO(g)+2NO2(g)=4CO2(g)+N2(g)△H=-1200kJ?mol-1,溫度不同 (T2>T1)其他條件相同時,下列圖象正確的是( )
A. 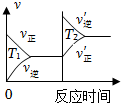
B. 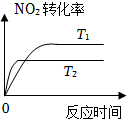
C. 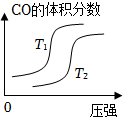
D. 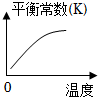 組卷:364引用:28難度:0.9
組卷:364引用:28難度:0.9 -
8.下列有關說法正確的是( )
A.等質量的硫蒸氣和硫固體分別完全燃燒,后者放出的熱量多 B.已知C(石墨,s)=C(金剛石,s)△H>0,故金剛石比石墨穩定 C.放熱且熵增加的反應不一定能正向自發進行 D.升高溫度能增大單位體積內的活化分子數,加快反應速率 組卷:43引用:11難度:0.7 -
 9.溫度為T℃向體積不等的恒容密閉容器中分別加入足量活性炭和1mol NO2,發生反應:2C(s)+2NO2(g)?N2(g)+2CO2(g)反應相同時間,測得各容器中NO2的轉化率與容器體積的關系如圖所示。下列說法正確的是( )
9.溫度為T℃向體積不等的恒容密閉容器中分別加入足量活性炭和1mol NO2,發生反應:2C(s)+2NO2(g)?N2(g)+2CO2(g)反應相同時間,測得各容器中NO2的轉化率與容器體積的關系如圖所示。下列說法正確的是( )A.T℃時,該反應在a點的化學平衡常數為 445B.圖中c點所示條件下,v正<v逆 C.向a點平衡體系中充入一定量的NO2,達到平衡時,NO2的轉化率比原平衡大 D.容器內的壓強:Pa:Pb>6:7 組卷:206引用:4難度:0.3 -
10.N2(g)+3H2(g)?2NH3(g) ΔH<0反應達到平衡狀態后,改變某一條件,下列圖像與條件變化一致的是( )
A.升高溫度 B.增大N2濃度 C.改變壓強 D.加入催化劑 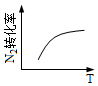
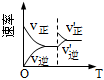
A.A B.B C.C D.D 組卷:33引用:4難度:0.5
四、簡答題(共20分)
-
30.習近平總書記在世界領導人氣候峰會上指出,中國將在2030年前實現“碳達峰”、2060年前實現“碳中和”。這是中國基于推動構建人類命運共同體的責任擔當和實現可持續發展的內在要求作出的重大戰略決策。因此CO2的捕集、創新利用與封存成為科學家研究的重要課題。
Ⅰ.最近有科學家提出“綠色自由”構想:先把空氣吹入飽和碳酸鉀溶液,然后再把CO2從溶液中提取出來,并使之變為可再生燃料甲醇。“綠色自由”構想技術流程如圖: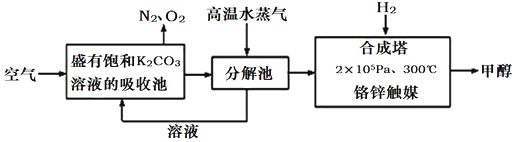
已知:
(1)上述工藝中采用氣液逆流接觸吸收(空氣從吸收池底部進入,溶液從頂部噴淋),其目的是化學鍵 H-H C-O C=O H-O C-H 鍵能/(kJ?mol-1 436 326 803 464 414 。
寫出吸收池中反應的化學方程式。
(2)根據上表鍵能寫出合成塔中反應的熱化學方程式。
(3)合成塔中制備甲醇的反應一般認為通過如下步驟來實現:
①CO2(g)+H2(g)=CO(g)+H2O(g)△H1
②CO(g)+2H2(g)=CH3OH(g)△H2=-90kJ?mol-1
若反應①為慢反應,下列示意圖中能體現上述反應能量變化的是。
A.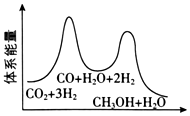
B.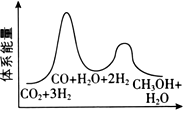
C.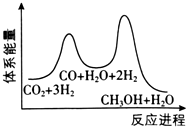
D.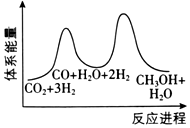
(4)下列物質能作為CO2捕獲劑的是(填標號)。
A.NaOH溶液
B.NH4Cl溶液
C.CH3CH2OH
D.濃氨水
Ⅱ.CO2和H2合成甲烷也是CO2資源化利用的重要方法。
(1)一定條件下Pd-Mg/SiO2催化劑可使CO2“甲烷化”從而變廢為寶,其反應機理如圖1所示,該反應的化學方程式為,反應過程中碳元素的化合價為-2價的中間體是。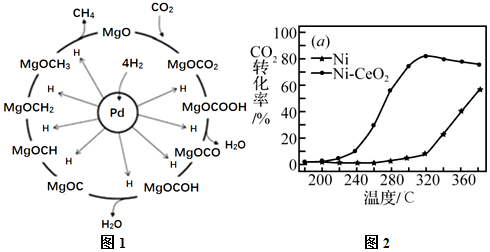
(2)催化劑的選擇是CO2甲烷化技術的核心。在兩種不同催化劑條件下反應相同時間,測得CO2轉化率隨溫度變化的影響如圖2所示。對比兩種催化劑的催化性能,工業上應選擇的催化劑是,使用的合適溫度為。組卷:24引用:3難度:0.6 -
31.研究減少CO2排放是一項重要課題。CO2經催化加氫可以生成低碳有機物,主要有以下反應:
反應Ⅰ:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)ΔH1=-49.6kJ/mol
反應Ⅱ:CH3OCH3(g)+H2O(g)?2CH3OH(g)ΔH2=+23.4kJ/mol
反應Ⅲ:2CO2(g)+6H2(g)?CH3OCH3(g)+3H2O(g)ΔH3
(1)反應II在某溫度下的平衡常數為0.25,此溫度下,在密閉容器中加入等物質的量的CH3OCH3(g)和H2O(g),反應到某時刻測得各組分濃度如下:
此時v正物質 CH3OCH3(g) H2O(g) CH3OH(g) 濃度/mol?L-1 1.8 1.8 0.4 v逆(填“>”、“<”或“=”),當反應達到平衡狀態時,混合氣體中CH3OH體積分數為%。
(2)恒壓下將CO2和H2按體積比1:3混合,在不同催化劑作用下發生反應I和反應III,在相同的時間段內CH3OH的選擇性和產率隨溫度的變化如圖。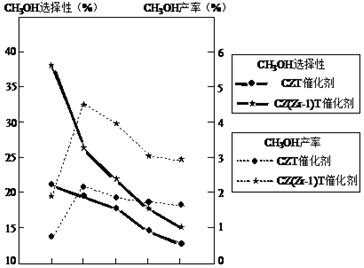
其中:CH3OH的選擇性=×100%CH3OH的物質的量反應的CO2的物質的量
①溫度高于230℃,CH3OH產率隨溫度升高而下降的原因是。
②在上述條件下合成甲醇的工業條件是。
A.210℃
B.230℃
C.催化劑CZT
D.催化劑CZ(Zr-1)T
(3)利用CO2的弱氧化性,開發了丙烷氧化脫氫制丙烯的新工藝。其反應機理如圖所示。
已知:CO和C3H6、C3H8的摩爾燃燒熱ΔH分別為-283?0kJ?mol-1、-2049.0kJ?mol-1、-2217.8kJ?mol-1。298K時,該工藝總反應的熱化學方程式為。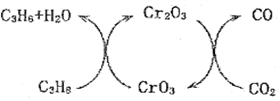 組卷:12引用:2難度:0.6
組卷:12引用:2難度:0.6


