2021-2022學年安徽省蕪湖一中高二(上)第一次診斷化學試卷
發布:2024/12/21 16:30:3
一、單項選擇舀(每小題5分,共60分)
-
1.下列變化中,屬于吸熱反應的是( )
①液態水氣化
②膽礬加熱變為白色粉末
③CaO固體加水溶解
④氯酸鉀分解制氧氣
⑤碳與氧氣反應生成一氧化碳A.①③⑤ B.②④ C.①② D.①②④ 組卷:4引用:1難度:0.5 -
2.下列說法或表示方法正確的是( )
A.由C(石墨,s)=C(金剛石,s)ΔH=+1.90kJ?mol-l可知,金剛石比石墨穩定 B.對于2SO2(g)+O2(g)?2SO2(g)ΔH=-QkJ?mol-1(Q>0),若反應中充入1molSO2和足量的氧氣反應時,放出的熱量為 kJQ2C.HCl與NaOH反應的中和熱ΔH=573kJ?mol-1,若將含1molHCl的稀鹽酸與1molNaOH固體混合,放出的熱量等于57.3kJ D.相同條件下,等質量的硫蒸氣和硫固體分別完全燃燒,前者放出熱量多 組卷:6引用:1難度:0.6 -
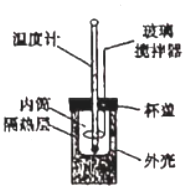 3.下列有關敘述正確的是( )
3.下列有關敘述正確的是( )A.如圖所示,測定中和熱時,隔熱層填滿碎紙條或泡沫塑料的目的是固定內筒 B.若用50mL0.55mol?L-1的氫氧化鈉溶液,分別與50mL0.50mol?L-1的鹽酸和50mL0.50mol?L-1的硫酸充分反應,兩反應測定的中和熱不相等 C.在測定中和熱的實驗中,一組完整的實驗數據至少需要測定并記錄的溫度是3次 D.中和熱測定實驗中的玻璃攪拌器可以由銅質攪拌器化替 組卷:7引用:1難度:0.7 -
4.對于可逆反應A(g)+3B(s)?2C(g)+2D(g),在不同條件下的化學反應速率如下,其中表示的反應速率最快的是( )
A.V(A)=0.5mol?L-1min-1 B.v(B)=1.2mol?L-1min-1 C.V(D)=0.4mol?L-1min-1 D.v(C)=0.1mol?L-1min-1 組卷:35引用:2難度:0.7 -
5.下列有關反應速率的說法錯誤的是( )
A.相同條件下,用2mL0.1mol/L的H2C2O4溶液分別與4mL0.1mol/L的KMnO4溶液、4mL0.2mol/L的KMnO4溶液反應,通過溶液褪色所需時間來探究濃度對速率的影響 B.相同條件下,用5mL0.1mol/L的Na2S2O3溶液分別與5mL0.1mol/L的H2SO4溶液分別在50℃和20℃反應,通過出現渾濁所需時間來探究溫度對速率的影響 C.化學反應速率的測定可以用反應物或生成物中任一種物質的濃度(或質量)相關的性質去測定 D.在糕點包裝中放置小包除氧劑,是為了改變速率而采取的措施 組卷:7引用:1難度:0.7
二、填空題(每空2分,共40分)
-
 14.某研究性學習小組利用H2C2O4溶液和酸性KMnO4溶液的反應探究“外界條件的改變對化學反應速率的影響”,進行了如下實驗:
14.某研究性學習小組利用H2C2O4溶液和酸性KMnO4溶液的反應探究“外界條件的改變對化學反應速率的影響”,進行了如下實驗:
(1)其中V1=實驗序號 實驗
溫度/K有關物質 溶液顏色褪至無色所需時間/s 酸性KMnO4溶液 H2C2O4溶液 H2O V/mL c/mol?L-1 V mL c/mol?L-1 V/mL A 293 2 0.02 4 0.1 0 t1 B T1 2 0.02 3 0.1 V1 8 C 313 2 0.02 V2 0.1 1 t2 、T1=;通過實驗(填實驗序號)可探究出溫度變化對化學反應速率的影響,其中V2=。
(2)若t1<8,則由此實驗可以得出的結論是;忽略溶液體積的變化,利用實驗B中數據計算,0~8s內,用KMnO4的濃度變化表示的反應速率v(KMnO4)=。
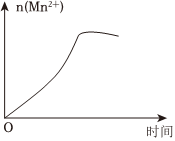
(3)該小組的一位同學通過查閱資料發現,上述實驗過程中n(Mn2+)隨時間的變化情況如圖所示,并認為造成這種變化的原因是反應體系中的某種粒子對KMnO4與草酸之間的反應有某種特殊作用,則該作用是。組卷:25引用:5難度:0.5 -
15.(1)如圖為計算機模擬的甲醇(CH3OH)制氫的反應歷程,其中吸附在催化劑表面上的物種用*標注。

可知總反應的ΔH0 (填“>”、“<”或“=”),所有歷程中最小能壘(活化能)E正=
kJ?mol-1,寫出該步驟的化學方程式。
(2)在容積可變的密閉容器中發生反應:mA (g)+nB (g)?pC (g),在一定溫度和不同壓強下達到平衡時,分別得到A的物質的量濃度如下表:
①當壓強從2×105Pa增加到5×105Pa時,平衡壓強p/Pa 2×105 5×105 1×106 c(A)/mol?L-1 0.08 0.20 0.44 移動(填:“向左”、“向右”或“不”).
②當壓強為1×106Pa時,平衡移動(域:“向左”、“向右”或“不”),寫出此時反應的平衡常數表達或:K=。
(3)溫度為T1時,在一個容積均為1L的密閉容器中僅發生反應:2NO(g)+O2(g)=-2NO2(g)ΔH<0。實驗測得:v正=v(NO)消耗=2v(O2)消耗=k正c2(NO)?c(O2),v逆=v(NO2)消耗=k逆c2(NO2),(k正,k逆為速率常數,受溫度影響)。
①溫度為T1時物質的起始濃度/mol?L-1 物質的平衡濃度mol?L-1 c(NO) c(O2) c(NO2) c(O2) 0.6 0.3 0 0.2 =K正K逆(填數據);當溫度升高為T2時,k正、k逆分別增大m倍和n倍,則mn(填“>”“<”或“=”)。
②T1時,在1L密閉容器中按照一定比例充入NO(g)和O2(g),達到平衡時NO2(g)的體積分數Φ(NO2)隨的變化如圖所示,則A、B、C三點中NO的轉化率最大的是;當n(NO)n(O2)=2.3時,達到平衡時Φ(NO2)可能是D、E、F三點中的n(NO)n(O2)。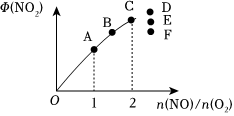 組卷:79引用:1難度:0.6
組卷:79引用:1難度:0.6


