2023年湖南省邵陽一中高考化學模擬試卷(五)
發布:2024/10/29 9:0:2
一、選擇題(本題共14個小題,每小題3分,共42分。每小題只有一項符合題目要求)
-
1.新型冠狀病毒的主要成分是蛋白質、核酸、脂肪及糖類物質,下列說法正確的是( )
A.蛋白質、核酸、脂肪及糖類在一定條件下都能水解,其中蛋白質水解的產物是氨基酸 B.蛋白質、核酸、脂肪及糖類都是高分子化合物 C.醫院可能采取高溫或者紫外線照射的方法能使蛋白質變性,殺死病毒 D.濃的K2SO4溶液能使溶液中的蛋白質析出,加水后析出的蛋白質不再溶解 組卷:149引用:3難度:0.6 -
2.設NA為阿伏加德羅常數的值。下列說法錯誤的是( )
A.標準狀況下,11.2L HF含有的分子數為0.5NA B.3.6g H2O中含有的質子數為2NA C.7.8g Na2S與Na2O2的混合物,含離子總數為0.3NA D.0.1mol Fe和0.1mol Cu分別與0.1mol Cl2完全反應,轉移電子數均為0.2NA 組卷:216引用:5難度:0.6 -
3.下列離子能大量共存,且加入相應試劑后發生反應的離子方程式書寫正確的是( )
選項 離子 加入試劑 加入試劑后發生反應的離子方程式 A Fe3+、Cl-、SO42-、K+ 銅粉 2Fe3++Cu=2Fe2++Cu2+ B K+、HCO3-、AlO2-、Cl- 鹽酸 H++AlO2-+H2O=Al(OH)3↓ C Na+、Fe2+、Br-、Mg2+ 氯氣 2 Br-+Cl2=Br2+2Cl- D NH4+、Na+、SO42-、HCO3- NaOH NH4++OH-=NH3?H2O A.A B.B C.C D.D 組卷:101引用:2難度:0.5 -
4.煉鐵工業中高爐煤氣的一種新的處理過程如圖所示,有關該過程的敘述錯誤的是( )
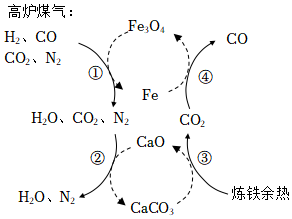
A.可減少CO2的排放 B.Fe3O4和CaO均可循環利用 C.過程①和④的轉化均為氧化還原反應 D.過程①的反應中有非極性鍵的斷裂和生成 組卷:71引用:8難度:0.8 -
5.W、X、Y、Z是原子序數依次增大的短周期主族元素,且原子序數總和為25,Y是地殼中含量最多的元素,由這四種元素形成的某化合物結構如圖所示。下列敘述正確的是( )
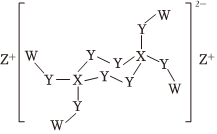
A.簡單離子半徑:Y<Z B.該化合物具有強氧化性,可殺菌消毒 C.該化合物中W、X、Y、Z最外層均達到8電子穩定結構 D.W分別與X、Y、Z形成的化合物所含化學鍵類型相同 組卷:1270引用:6難度:0.5 -
6.定量實驗是學習化學的重要途徑。下列所示裝置或操作能達到實驗目的的是( )
A B C D 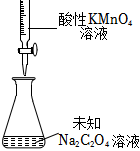
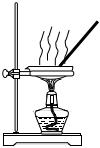
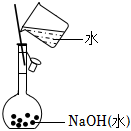
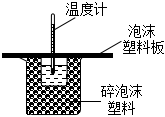
測定未知Na2C2O4溶液的濃度 測定硫酸銅晶體中結晶水的含量 配制0.10mol/LNaOH溶液 中和熱的測定 A.A B.B C.C D.D 組卷:59引用:6難度:0.7
二、非選擇題(共4個大題,58分)
-
17.碳排放問題是第26屆聯合國氣候變化大會討論的焦點。我國向國際社會承諾2030年“碳達峰”,2060 年實現“碳中和”。為了實現這個目標,加強了對CO2轉化的研究。下面是CO2轉化為高附加值化學品的反應。相關反應的熱化學方程式如下:
反應Ⅰ:CO2(g)+H2(g)?H2O(g)+CO(g)ΔH1
反應Ⅱ:CO(g)+2H2(g)?CH3OH(g)ΔH2=-90.0kJ?mol-1
反應Ⅲ:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)ΔH3=-49.0kJ?mol-1
反應Ⅳ:CO2(g)+4H2(g)?CH4(g)+2H2O(g)ΔH4=-165.0kJ?mol-1
反應Ⅴ:2CO2(g)+6H2(g)?C2H4(g)+4H2O(g)ΔHs=-122.7kJ?mol-1
回答下列問題:
(1)反應Ⅲ一般認為通過反應Ⅰ、Ⅱ來實現,則反應Ⅰ的ΔH1=kJ?mol-1;
已知:由實驗測得反應Ⅰ的v正=k正c(CO2)?c(H2),v逆=k逆?c(H2O)?c(CO)(k正、k逆為速率常數,與溫度、催化劑有關)。若平衡后升高溫度,則k逆k正(填“增大”、“不變”或“減小”)。
(2)在2L恒容密閉容器中充入總物質的量為8mol的CO2和H2發生反應III,改變氫碳比[],在不同溫度下反應達到平衡狀態,測得的實驗數據如表:n(H2)n(CO2)
①下列說法中正確的是溫度/K
CO2轉換率n(H2)n(CO2)500 600 700 800 1.5 45 33 20 12 2.0 60 43 28 15 3.0 83 62 40 22 (填英文字母)。
A.增大氫碳比,平衡正向移動,平衡常數增大
B.v(CH3OH)=v(CO2)時,反應達到平衡
C.當混合氣體平均摩爾質量不變時,達到平衡
D.當混合氣體密度不變時,達到平衡
②在700K、氫碳比為3.0的條件下,某時刻測得容器內CO2、H2、CH3OH、H2O的物質的量分別為2mol、2mol、1mol 和1mol,則此時正反應速率和逆反應速率的關系是(填英文字母)。
A.v(正)>v(逆)
B..v(正)<v(逆)
C.v(正)=v(逆)
D.無法判斷
(3)CO2在一定條件下催化加氫生成CH3OH,主要發生三個競爭反應(即反應Ⅲ、Ⅳ、Ⅴ),為分析催化劑對反應的選擇性,在1L恒容密閉容器中充入2.0mol CO2和5.3mol H2,測得反應進行相同時間后,有關物質的物質的量隨溫度變化如圖1所示: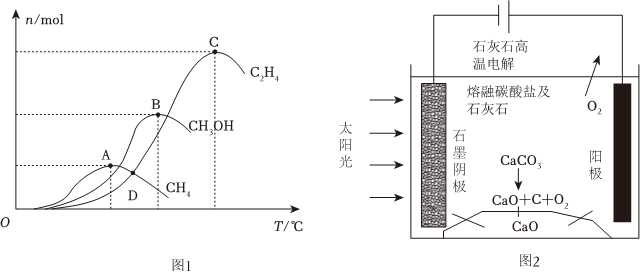
①該催化劑在較低溫度時主要選擇反應(“Ⅲ”或“Ⅳ”或“Ⅴ”)。研究發現,若溫度過高,三種含碳產物的物質的量會迅速降低,其主要原因可能是:。
②在一定溫度下達到平衡,此時測得容器中部分物質的含量為:n(CH4)=0.1mol,n(C2H4)=0.4mol,n(CH3OH)=0.5mol。則該溫度下反應Ⅲ的平衡常數K(Ⅲ)=L2/mol2 (保留兩位小數)。
(4)常溫下,用NaOH溶液作CO2捕捉劑不僅可以降低碳排放,而且可得到重要的化工產品Na2CO3。欲用1LNa2CO3溶液將2.33gBaSO4固體全都轉化為BaCO3,則所用的Na2CO3溶液的物質的量濃度至少為mol/L (已知:常溫下Ksp(BaSO4)=1×10-11,Ksp (BaCO3)=1×10-10。忽略溶液體積的變化,保留兩位有效數字)。
(5)研究人員研究出一種方法,可實現水泥生產時CO2零排放,其基本原理如圖2所示。溫度小于900℃時進行電解反應,碳酸鈣先分解為CaO和CO2,電解質為熔融碳酸鈉,陽極的電極反應式為2-4e-═2CO2↑+O2↑,則陰極的電極反應式為CO2-3。組卷:29引用:3難度:0.5 -
18.化合物H是一種新型抗癌藥物的中間體,其一種合成路線如圖:
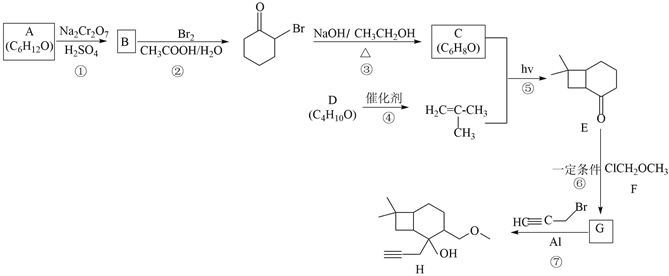
回答下列問題:
(1)A的結構簡式為,寫出H中除醚鍵(-O-)外的另外兩種官能團的名稱。
(2)④的反應類型為,G的結構簡式為。
(3)反應③的化學方程式為反應⑤可能產生與E互為同分異構體的副產物,其結構簡式為。
(4)芳香化合物M是H的同分異構體。已知M的苯環上只有3個取代基且分子結構中不含-OH,M中僅含四種不同化學環境的氫原子,則M的結構簡式為(任寫一種)。
(5)參照上述合成路線,設計由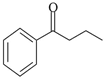 合成
合成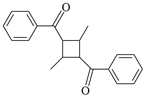 的路線 (乙醇、乙酸及無機試劑任選)。(合成路線常用的表達方式為:
的路線 (乙醇、乙酸及無機試劑任選)。(合成路線常用的表達方式為: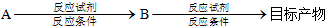 )組卷:16引用:1難度:0.6
)組卷:16引用:1難度:0.6


