2020-2021學年天津市紅橋區高三(上)期中化學試卷
發布:2024/12/27 17:0:4
一、選擇題(每小題只有一個選項最符合題意,每小題3分,共36分)
-
1.下列變化,是將電能轉化為化學能的是( )
A.風力發電 B.天然氣燃燒 C.南孚電池放電 D.電解氯化銅溶液 組卷:3引用:1難度:0.7 -
2.下列物質屬于電解質且能導電的是( )
A.金屬銅 B.鹽酸 C.熔融KCl D.酒精 組卷:27引用:4難度:0.6 -
3.在西漢劉安編撰的《淮南萬畢術》中,有“曾青得鐵則化為銅”的記載。說明西漢時期,我國勞動人民就已經發現鐵能從某些含銅(+2價)化合物的溶液中置換出銅,這個方法是現代濕法冶金的基礎,下列說法中,不正確的是( )
A.該反應的離子反應方程式為:Fe+Cu2+=Cu+Fe2+ B.該反應屬于氧化還原反應,反應中鐵被氧化 C.該反應說明金屬單質都能與鹽發生反應 D.該反應說明鐵的金屬性比銅的強 組卷:61引用:2難度:0.8 -
4.下列離子方程式不正確的是( )
A.Na2O2溶于水:2Na2O2+2H2O═4Na++4OH-+O2↑ B.Cu與FeCl3反應:Cu+Fe3+═Fe2++Cu2+ C.Al2O3溶于鹽酸:Al2O3+6H+═2Al3++3H2O D.Al溶于NaOH溶液:2Al+2OH-+2H2O═2AlO2-+3H2↑ 組卷:5引用:1難度:0.7 -
5.下列離子組一定大量共存的是( )
A.FeCl3溶液中:Fe2+、Cu2+、I-、SO42- B.AlCl3溶液中:Mg2+、Fe3+、Fe2+、SO42- C.FeCl2溶液中:Mg2+、Ag+、MnO4-、NO3- D.酸性溶液中:Al3+、Na+、ClO-、SO42- 組卷:32引用:2難度:0.5
二、第Ⅱ卷
-
15.有科學家預言,氫能將成為21世紀的主要能源,而且是一種理想的綠色能源.
(1)氫能被稱為綠色能源的原因是(任答一點)
(2)在101kPa下,2g氫氣完全燃燒生成液態水放出285.8kJ的熱量,請回答下列問題
①該反應生成物總能量反應物總能量(填“大于”,“小于”或“等于”)
②氫氣的燃燒熱為
③該反應的熱化學方程式為
④若1mol氫氣完全燃燒生成1mol氣態水放出241kJ的熱量,已知H-H鍵能為436kJ?mol-1,O=O鍵能為498kJ?mol-1,計算H-O鍵能為kJ?mol-1
(3)氫能的存儲是氫能利用的前提,科學家研究出一種儲氫合金Mg2Ni,已知:
Mg(s)+H2(g)═MgH2(s)△H1=-74.5kJ?mol-1;
Mg2Ni(s)+2H2(g)═Mg2NiH4(s)△H2=-64.4kJ?mol-1;
Mg2Ni(s)+2MgH2(s)═2Mg(s)+Mg2NiH4(s)△H3.
則△H3=kJ?mol-1.組卷:125引用:8難度:0.1 -
16.H2O2是一種重要的化學品,其合成方法不斷發展。
(1)早期制備方法: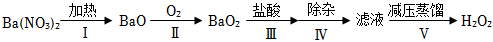
①Ⅰ為分解反應,產物除BaO、O2外,還有種紅棕色氣體。該物質是。
②Ⅱ為可逆反應,促進該反應正向進行的措施是。
③Ⅲ中生成H2O2,反應的化學方程式是。
④減壓能夠降低蒸餾溫度,從H2O2的化學性質角度說明Ⅴ中采用減壓蒸餾的原因:。
(2)電化學制備方法:已知反應2H2O2═2H2O+O2↑能自發進行,反向不能自發進行,通過電解可以實現由H2O和O2為原料制備H2O2,如圖為制備裝置示意圖。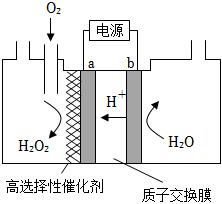
①a極的電極反應式是。
②下列說法正確的是。
A.該裝置可以實現電能轉化為化學能
B.電極b連接電源負極
C.該方法相較于早期制備方法具有原料廉價,對環境友好等優點組卷:5引用:3難度:0.5


