2019-2020學年北京師大二附中高三(上)期中化學試卷
發布:2024/4/20 14:35:0
一、選擇題(共14小題,每小題3分,滿分42分)
-
1.下列我國科研成果所涉及材料中,主要成分為同主族元素形成的無機非金屬材料的是( )
A. 
4.03米大口徑碳化硅反射鏡B. 
2022年冬奧會聚氨酯速滑服C. 
能屏蔽電磁波的碳包覆銀納米線D. 
“玉兔二號”鈦合金篩網輪組卷:573引用:23難度:0.9 -
2.關于營養物質的下列說法不正確的是( )
A.油脂屬于有機高分子化合物 B.淀粉能水解為葡萄糖 C.雞蛋煮熟過程中蛋白質變性 D.食用新鮮蔬菜和水果可補充維生素C 組卷:26引用:4難度:0.7 -
3.關于鈉及其化合物的化學用語正確的是( )
A.鈉原子的結構示意圖: 
B.過氧化鈉的電子式: 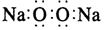
C.碳酸氫鈉的電離方程式:NaHCO3═Na++H++CO32- D.次氯酸鈉水溶液呈堿性的原因:ClO-+H2O?HClO+OH- 組卷:36引用:3難度:0.8 -
4.咖啡酸具有較廣泛的抑菌作用,其結構簡式如下。下列關于咖啡酸的說法不正確的是( )

A.能發生加聚反應 B.能與溴水發生反應 C.能與H2發生加成反應 D.1 mol咖啡酸最多消耗1 mol NaOH 組卷:90引用:3難度:0.7 -
5.下列實驗現象與氧化還原反應無關的是( )
A.銅遇濃硝酸產生紅棕色氣體 B.氨氣與氯化氫氣體相遇產生白煙 C.過氧化鈉放置于空氣中逐漸變白 D.石蕊溶液滴入氯水中先變紅后無色 組卷:0引用:1難度:0.5 -
6.下列解釋事實的化學用語不正確的是( )
A.測0.1mol/L氨水的pH為11:NH3?H2O?NH4++OH- B.將Na塊放入水中,放出氣體:2Na+2H2O═2NaOH+H2↑ C.用CuCl2溶液做導電實驗,燈泡發光:CuCl2 Cu2++2Cl-通電D.SiO2溶于NaOH溶液中:SiO2+2OH-═SiO32-+H2O 組卷:4引用:1難度:0.7
二、解答題(共5小題,滿分58分)
-
18.利用某含鉻廢液[含較低濃度的Na2Cr2O7、Fe2(SO4)3]制備K2Cr2O7流程如下:Ⅰ.用NaOH溶液調pH至3.6,產生紅褐色沉淀,過濾;
Ⅱ.向濾液中加入Na2SO3,一定操作后分離出Na2SO4;
Ⅲ.將分離出Na2SO4后的溶液調pH約為5,得到Cr(OH)3沉淀;
Ⅳ.在KOH存在條件下,向Cr(OH)3中加入足量H2O2溶液,得到黃色溶液;
Ⅴ.向黃色溶液中加入物質A后,溶液變為橙紅色,一定操作后得到K2Cr2O7固體;
Ⅵ.測定K2Cr2O7固體的純度.
已知:Cr2O72-(橙紅色)+H2O?2CrO42-(黃色)+2H+
(1)步驟Ⅰ中紅褐色沉淀的化學式是.
(2)步驟Ⅱ中加入Na2SO3的目的是.
(3)步驟Ⅳ中反應的離子方程式是.
(4)步驟Ⅴ中加入的物質A可以是.(填序號)
a.KOH b.K2CO3 c.H2SO4 d.SO2
(5)步驟Ⅵ的操作是:取0.45g K2Cr2O7產品配成溶液,酸化后滴入18.00mL,50mol/L的FeSO4溶液,恰好使Cr2O72-完全轉化為Cr3+.產品中K2Cr2O7的純度是.(注:K2Cr2O7的摩爾質量為294g/mol)
(6)向橙紅色的K2Cr2O7溶液中,滴加Ba(NO3)2溶液,產生黃色沉淀,溶液pH減小.試推測黃色沉淀是,溶液pH變小的原因是.組卷:18引用:3難度:0.1 -
19.探究0.5mol/L FeCl3溶液(pH=1)與不同金屬反應時的多樣性的原因。
(各組實驗中:所用FeCl3溶液體積相同;金屬過量;靜置、不振蕩)
(1)根據實驗Ⅰ中的現象,推測紅褐色液體為膠體,并用光束照射該液體,在與光束垂直的方向觀察到編號 金屬 現象及產物檢驗 Ⅰ 鎂條 立即產生大量氣體,金屬表面變黑,該黑色固體能被磁鐵吸引,液體顏色由棕黃色逐漸變為紅褐色;
片刻后氣泡減少,金屬表面覆蓋有紅褐色沉淀,此時取反應后的液體,滴加K3[Fe(CN)6]溶液,生成藍色沉淀。Ⅱ 銅粉 無氣體產生,溶液逐漸變為藍綠色;
取反應后的溶液,滴加K3[Fe(CN)6]溶液,生成藍色沉淀。得以證實。
(2)已知:Fe和Fe3O4均能被磁鐵吸引。
①為了確定黑色固體的成分是否含有Fe與Fe3O4,重復實驗Ⅰ,及時取少量鎂條表面生成的黑色粉末,洗凈后進行實驗如下: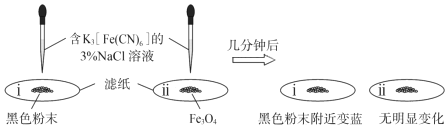
該實驗說明黑色固體中一定含有,結合現象寫出判斷的理由:。
②除上述結論外,分析實驗Ⅰ的現象,可知被還原得到的產物一定還有。
(3)實驗Ⅰ、Ⅱ中現象的差異,與Fe3+、Mg2+、Fe2+、H+、Cu2+的氧化性強弱有關,其順序是Mg2+<Fe2+<。
(4)繼續探究0.5mol/L FeCl3溶液(pH=1)與Fe的反應。
①實驗Ⅲ中發生反應的離子方程式有編號 金屬 現象及產物檢驗 Ⅲ 鐵粉 持續產生少量氣體;一段時間后,溶液顏色變淺,底部有紅褐色沉淀,經檢驗,溶液pH=4,含有Fe2+,無Fe3+. Ⅳ 鐵絲 無明顯的氣泡產生;一段時間后,溶液變為淺綠色,經檢驗,溶液pH=2,含有Fe2+和Fe3+;Fe3+被還原的量多于實驗Ⅲ. 。
②已知:相同條件下,H+在溶液中的移動速率遠大于Fe3+.結合實驗Ⅰ、Ⅱ,由反應中金屬表面離子濃度的變化,推測實驗Ⅲ、Ⅳ現象差異的原因:。組卷:69引用:3難度:0.4


