2021-2022學年江蘇省蘇州市常熟中學高一(上)質檢化學試卷(12月份)
發布:2024/10/27 1:30:2
一、選擇題(共15小題,每小題3分,滿分45分)
-
1.海水是一個巨大的化學資源庫,下列有關海水綜合利用的說法正確的是( )
A.海水中含有鎂元素,只需經過物理變化就可以得到鎂單質 B.海水蒸發制海鹽的過程中只發生了物理變化 C.從海水中可以得到NaCl,電解飽和食鹽水可制備Na D.海水中的溴、碘可用四氯化碳直接萃取得到 組卷:15引用:1難度:0.8 -
2.下列化學用語描述正確的是( )
A.可用于考古斷代的一種核素的符號: C136B.氚的原子結構模型: 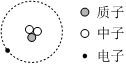
C.18O2-離子的結構示意圖: 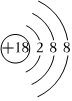
D.14C和14N互為同位素 組卷:77引用:9難度:0.8 -
3.下列關于鈉及其化合物的說法正確的是( )
A.純堿顯堿性可用于除油污,也可用于治療胃酸過多 B.金屬鈉著火不能用水撲滅,要用干冰滅火器 C.等質量的鈉與氧氣在不同條件下反應生成氧化鈉和過氧化鈉時轉移電子數相同 D.鈉的化學性質活潑,可從TiCl4溶液中置換出Ti 組卷:10引用:1難度:0.6 -
4.下列關于氯的說法正確的是( )
A.1mol氯氣與NaOH反應轉移2mol電子 B.35Cl、37Cl為不同的原子,化學性質不同 C.氯水久置后pH值減小,漂白性減弱 D.干燥的氯氣不能使鮮花褪色 組卷:95引用:3難度:0.6 -
5.下列反應的離子方程式書寫正確的是( )
A.鈉和水反應:Na+H2O═Na++OH-+H2↑ B.鹽酸與氧化鈉反應:2H++O2-═H2O C.NaHSO4與足量Ba(OH)2溶液反應:Ba2++OH-+H++SO42-═BaSO4↓+H2O D.碳酸鈣與醋酸反應制備二氧化碳:CaCO3+2H+═Ca2++H2O+CO2↑ 組卷:7引用:1難度:0.7 -
6.下列有關NaHCO3與Na2CO3的說法中,正確的是( )
A.分別加熱兩種樣品,沒有殘留物質的是NaHCO3 B.等物質的量的固體,分別與相同體積、相同物質的量濃度的鹽酸反應,產生CO2的速率:NaHCO3═Na2CO3 C.分別配成溶液,再加入石灰水,無白色沉淀生成的NaHCO3 D.等濃度的碳酸鈉和鹽酸等體積混合,混合方式不同,產生二氧化碳體積可能不同 組卷:69引用:1難度:0.7
二、解答題(共5小題,滿分55分)
-
19.海水資源的利用具有非常廣闊的前景。如圖是海水綜合利用聯合工業體系的簡圖,回答下列問題:

Ⅰ.海水淡化:
(1)人類可以從海水中獲得淡水,以解決水資源危機。海水淡化的方法可采用操作。
Ⅱ.海水制鹽
(2)過程Ⅰ采用的操作是;用到的玻璃儀器有。
(3)粗鹽中可溶性的雜質離子有、Mg2+、Ca2+。要除去這些雜質離子得到精鹽水,過程Ⅱ依次加入了試劑順序可選擇SO2-4(填字母),其中Na2CO3溶液的作用是。
a.NaOH溶液、BaCl2溶液、Na2CO3溶液、鹽酸
b.BaCl2溶液、NaOH溶液、Na2CO3溶液、鹽酸
c.NaOH溶液、Na2CO3溶液、BaCl2溶液、鹽酸
d.BaCl2溶液、Na2CO3溶液、NaOH溶液、鹽酸
Ⅲ.海水提溴
(4)工業上從海水中提取溴單質的流程圖中,步驟④中SO2作劑。
(5)經過步驟①②已獲得Br2,不直接用含Br2的海水進行蒸餾得到液溴,而要經過“空氣吹出、SO2吸收、通入氯氣”后再蒸餾,其目的是;
Ⅳ.海水提鎂
(6)該工業生產過程中,不涉及的基本反應類型為;
(7)寫出Mg(OH)2與鹽酸反應生成氯化鎂溶液的離子方程式。組卷:15引用:1難度:0.7 -
20.把27.4gNa2CO3和NaHCO3的固體混合物溶于足量的水配成溶液,在其中加入足量1mol/L的鹽酸,反應完全以后可以生成6.72LCO2(標準狀況下)。
(1)求固體混合物中Na2CO3的質量?
(2)若在上述Na2CO3和NaHCO3的混合溶液中逐滴滴加1mol/L的鹽酸150mL,反應完全可生成氣體多少升(標準狀況下)。組卷:26引用:1難度:0.4


