2021-2022學年江西省九江一中高二(上)期中化學試卷
發布:2024/4/20 14:35:0
一、選擇題(本題共25小題,每小題2分,共50分。每小題只有一個選項符合題意)
-
1.下列能源的大量使用會導致全球進一步變暖、霧霾天氣增多的是( )
A.化石能源 B.太陽能 C.氫能 D.地熱能 組卷:113引用:25難度:0.9 -
2.下列反應中,屬于吸熱反應的是( )
A.甲烷燃燒 B.碳酸鈣受熱分解 C.鋁熱反應 D.鹽酸和氫氧化鈉反應 組卷:3引用:1難度:0.6 -
3.下列說法中,正確的是( )
A.凡是放熱反應都是自發反應 B.凡是熵增大的反應都是自發反應 C.要判斷反應能否自發進行,必須綜合考慮體系的焓變和熵變 D.非自發進行的反應一定不可能發生反應 組卷:8引用:1難度:0.7 -
4.下列事實中,能說明HCN是弱電解質的是( )
A.1molHCN與1molNaOH恰好完全反應 B.NaCN是強電解質 C.HCN溶液的導電性比鹽酸的弱 D.NaCN溶液呈堿性 組卷:1引用:1難度:0.7 -
5.下列說法正確的是( )
A.反應熱就是反應中放出的能量 B.已知某反應的焓變小于零,則破壞反應物全部化學鍵所吸收的能量小于形成生成物全部化學鍵所釋放的能量 C.由C(石墨)→C(金剛石)ΔH=+1.9kJ/mol可知,金剛石比石墨穩定 D.ΔH的大小與熱化學方程式的化學計量數無關 組卷:2引用:1難度:0.5 -
6.下列電離方程式書寫正確的是( )
A.NaHCO3═Na++H++CO32- B.HF?H++F- C.H2SO4?2H++SO42- D.CH3COONH4?CH3COO-+NH4+ 組卷:236引用:8難度:0.7 -
7.已知428℃時,H2(g)+I2(g)?2HI(g)的平衡常數為49,則該溫度下2HI(g)?H2(g)+I2(g)的平衡常數是( )
A. 149B. 17C.492 D.無法確定 組卷:17引用:11難度:0.9 -
8.下列事實不能用勒夏特列原理來解釋的是( )
A.高壓有利于氫氣與氮氣合成氨 B.實驗室中常用排飽和食鹽水的方法收集Cl2 C.工業上生產硫酸時,充入過量的空氣以提高SO2的轉化率 D.H2、I2、HI平衡混合氣體加壓后顏色加深H2(g)+I2(g)?2HI(g) 組卷:3引用:1難度:0.7 -
9.反應3Fe(s)+4H2O(g)?Fe3O4(s)+4H2(g)在一密閉容器中進行,下列條件的改變對其化學反應速率幾乎無影響的是( )
A.保持容積不變,增加H2O(g)的物質的量 B.將容器的容積縮小一半 C.保持容積不變,充入Ar D.保持壓強不變,充入Ar 組卷:77引用:12難度:0.6 -
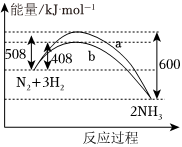 10.如圖表示298K時N2與H2反應過程中的能量變化,根據圖所示下列敘述正確的是( )
10.如圖表示298K時N2與H2反應過程中的能量變化,根據圖所示下列敘述正確的是( )A.該反應的熱化學方程式為:N2(g)+3H2(g)?2NH3(g) ΔH=-92kJ?mol-1 B.不用催化劑,生成1molNH3吸收的熱量為46kJ C.加入催化劑,會改變該反應的反應熱 D.曲線b表明加入催化劑降低了反應熱,從而加快了反應速率 組卷:10引用:2難度:0.5
二、填空題(共50分>
-
30.恒溫下,在容積為2L的恒容密閉容器A中通入1mol N2與1mol H2的混合氣體,發生如下反應:N2 (g)+3H2(g)?2NH3(g),△H<0,一段時間后,達到平衡,若平衡時氨氣的物質的量為0.4mol.
(1)計算此溫度時該反應的K=,平衡時H2的轉化率為.
(2)若在此溫度下,向另一容積為3L的恒容容器B中按物質的量分別為0.4mol、0.3mol、0.3mol充入N2、H2、NH3,此時,該反應是否處于平衡狀態(填“是”或“否”),此時若沒有達平衡,反應向方向進行,其判斷依據是.組卷:18引用:3難度:0.3 -
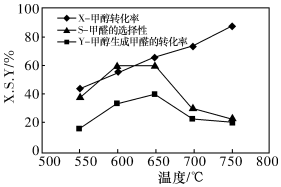 31.甲醛(HCHO)是一種用途非常廣泛的化工原料,其制備方法多樣。
31.甲醛(HCHO)是一種用途非常廣泛的化工原料,其制備方法多樣。
方法:(氧化法)2CH3OH(g)+O2(g)═2HCHO(g)+2H2O(g)ΔH1=-316kJ/mol
(脫氫法)CH3OH(g)═HCHO(g)+H2(g)ΔH2
(1)已知:2H2(g)+O2(g)═2H2O(g)ΔH=-484kJ/mol,則ΔH2=。
(2)已知甲醇脫氫制甲醛過程中,副反應的產物主要是CO等。Na2CO3,可做該反應的催化劑,有研究指出,催化反應的部分機理如下:
歷程ⅰ:CH3OH→?H+?CH2OH
歷程ⅱ:?CH2OH→?H+HCHO
歷程ⅲ:?CH2OH→3?H+CO
歷程ⅳ:?H+?H→H2
如圖表示一定條件下Na2CO3催化甲醇脫氫制甲醛的反應中,甲醇的轉化率、甲醛的選擇性(選擇性越大,表示生成該物質越多)、甲醇生成甲醛的轉化率隨溫度的變化關系,回答下列問題:
①從平衡角度解析550~650℃甲醇生成甲醛的轉化率隨溫度升高的原因。
②溫度高于650℃后,甲醛選擇性迅速下降的原因可能是。組卷:26引用:1難度:0.6


