2021-2022學(xué)年江蘇省南通市海安市高三(上)期初化學(xué)試卷
發(fā)布:2024/11/1 17:30:3
一、單項(xiàng)選擇題:本題包括14小題,每小題3分,共計(jì)42分。每小題只有一個(gè)選項(xiàng)符合愿意。
-
1.下列有關(guān)我國科技成果的描述正確的是( )
A.“嫦娥五號”使用的太陽能電池陣和鋰離子電池組,均可將化學(xué)能轉(zhuǎn)變?yōu)殡娔?/label> B.“神舟十一號”宇宙飛船返回艙外表面使用的高溫結(jié)構(gòu)陶瓷是有機(jī)高分子材料 C.港珠澳大橋使用的聚乙烯纖維纜繩,具有質(zhì)量輕、強(qiáng)度大、耐腐蝕等優(yōu)點(diǎn) D.我國提出網(wǎng)絡(luò)強(qiáng)國戰(zhàn)略,光纜線路總長超過三千萬公里,光纜的主要成分是晶體硅 組卷:25引用:1難度:0.7 -
2.NF3是一種優(yōu)良的蝕刻氣體。HF、F2均可用于制備NF3,F(xiàn)2制備NF3的反應(yīng)為:4NH3+3F2
NF3+3NH4F。下列說法正確的是( )CuA.中子數(shù)為10的氟原子: F1910B.HF的電子式: 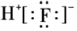
C.NF3分子中,氮原子的雜化類型為sp2 D.電負(fù)性:F>N>H 組卷:17引用:1難度:0.3 -
3.1935年,在中國化學(xué)家侯德榜的領(lǐng)導(dǎo)下,中國建成了第一座生產(chǎn)合成氨、硝酸等的聯(lián)合企業(yè)——永利制堿廠。該企業(yè)首先合成氨,氨再經(jīng)鉑銠催化劑催化氧化得到NO,將NO、水和空氣通入吸收塔中得到硝酸。氨催化氧化法制取NO的反應(yīng)為:4NH3(g)+5O2(g)?4NO(g)+6H2O(g)ΔH=-905.8kJ/mol。如圖為NH3的制備,收集及催化氧化實(shí)驗(yàn),下列說法正確的是( )
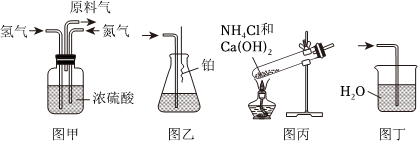
A.圖甲裝置除了混合氫氣和氮?dú)庵膺€可以干燥氣體及觀察氫氣和氮?dú)獾牧魉?/label> B.將氨氣通入圖乙裝置中,錐形瓶口出現(xiàn)紅棕色氣體,說明氨被直接氧化為NO2 C.圖丙為實(shí)驗(yàn)室制取氨氣的正確裝置 D.圖丁裝置可用于實(shí)驗(yàn)室制氨氣的尾氣吸收 組卷:53引用:1難度:0.7 -
4.1935年,在中國化學(xué)家侯德榜的領(lǐng)導(dǎo)下,中國建成了第一座生產(chǎn)合成氨、硝酸等的聯(lián)合企業(yè)——永利制堿廠。該企業(yè)首先合成氨,氨再經(jīng)鉑銠催化劑催化氧化得到NO,將NO、水和空氣通入吸收塔中得到硝酸。氨催化氧化法制取NO的反應(yīng)為:4NH3(g)+5O2(g)?4NO(g)+6H2O(g)△H=-905.8kJ/mol。下列關(guān)于工業(yè)上由氨氣制取濃硝酸的過程說法正確的是( )
A.NH3的空間構(gòu)型為平面三角形 B.催化氧化法制取NO過程中,升高溫度,可以增大該反應(yīng)的平衡常數(shù) C.反應(yīng)中每消耗22.4L(標(biāo)準(zhǔn)狀況) NH3可放出熱量226.45kJ D.4mol NH3(g)和5mol O2(g)所含能量總和比4mol NO(g)和6mol H2O(g)的總能量小 組卷:14引用:2難度:0.7 -
5.TiO2的“納米材料“有廣泛的應(yīng)用,工業(yè)上可利用TiCl4制取。TiCl4熔點(diǎn)為-25℃,沸點(diǎn)為136.4℃,易溶于有機(jī)溶劑。制取TiO2的反應(yīng)為:①2FeTiO3+7Cl2+3C
2TiCl4+2FeCl3+3CO2;②TiCl4+O2=TiO2+2Cl2。下列說法正確的是( )△A.基態(tài)Ti原子核外價(jià)電子排布式為4s2 B.Cl2、CO2都是含有非極性鍵的非極性分子 C.TiCl4晶體是離子晶體,配位數(shù)為4 D.反應(yīng)①每生成1mol FeCl3轉(zhuǎn)移電子的物質(zhì)的量為7mol 組卷:7引用:3難度:0.7 -
6.Na2SO4和焦炭可發(fā)生化學(xué)反應(yīng),某興趣小組對該反應(yīng)及其產(chǎn)物進(jìn)行如圖所示實(shí)驗(yàn)探究。下列說法錯(cuò)誤的是
( )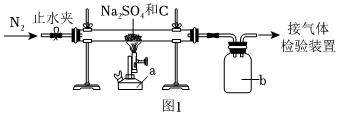
A.c裝置的主要作用是防倒吸 B.實(shí)驗(yàn)時(shí),應(yīng)先通入N2再加熱 C.實(shí)驗(yàn)后a裝置中固體可能會與稀硫酸反應(yīng)產(chǎn)生淡黃色固體 D.b處連接的裝置中依次盛放澄清石灰水、品紅溶液、NaOH溶液 組卷:50引用:2難度:0.5
二、非選擇題,共4題,共58分。
-
17.葡萄糖酸鋅[Zn(C6H11O7)2]是一種有機(jī)補(bǔ)鋅劑,廣泛應(yīng)用于食藥領(lǐng)域。已知葡萄糖酸鋅能溶于水,易溶于熱水,不溶于乙醇,稍高于100℃即開始分解。某小組由葡萄糖制備葡萄糖酸鋅的實(shí)驗(yàn)步驟如下:
Ⅰ.制備葡萄糖酸(C6H12O7):60℃水浴下,向一定體積葡萄糖溶液中滴入1%溴水至略過量,保溫5min。
Ⅱ.制備葡萄糖酸鈣[Ca(C6H11O7)2]:將略過量高純CaCO3粉末緩慢加入上述溶液,在水浴中振蕩,直至無氣泡產(chǎn)生。過濾,冷卻并加入等體積乙醇,產(chǎn)生沉淀。過濾,用乙醇洗滌固體,溶水待用。
Ⅲ.制備葡萄糖酸鋅粗品:在90℃水浴、攪拌下,向ZnSO4溶液中分批加入葡萄糖酸鈣溶液。趁熱過濾,向?yàn)V液中加入無水乙醇并冷卻析晶,過濾。
請回答下列問題:
(1)步驟Ⅰ中發(fā)生反應(yīng)的化學(xué)方程式為。
(2)步驟Ⅲ中反應(yīng)控溫在90℃的原因?yàn)?。
(3)步驟Ⅲ中向?yàn)V液中加入無水乙醇的作用是。
(4)高純CaCO3的制備。請?jiān)O(shè)計(jì)以石灰石(含少量鐵的氧化物,其他雜質(zhì)不考慮)、鹽酸,碳酸銨溶液為原料制備高純碳酸鈣的實(shí)驗(yàn)方案:邊攪拌邊將石灰石粉末分批加入稀鹽酸中,至不再有氣泡產(chǎn)生,,得到高純CaCO3。(實(shí)驗(yàn)中須使用的試劑有:氨水、H2O2溶液、HNO3溶液、AgNO3溶液)組卷:6引用:1難度:0.7 -
18.煙氣中SO2和NO的轉(zhuǎn)化和綜合利用既有利于節(jié)約資源,又有利于保護(hù)環(huán)境。
(1)采用NaClO2溶液作為吸收劑可同時(shí)對煙氣進(jìn)行脫硫、脫硝,在一定濃度的NaClO2溶液中通入含有SO2和NO的煙氣,反應(yīng)溫度為323K。
已知:4H++ClO2-═4ClO2+Cl-+2H2O;ClO2氧化性大于NaClO2。
①寫出NaClO2溶液將NO氧化為NO3-的離子方程式:。
②已知脫硫反應(yīng)速率大于脫硝反應(yīng)速率,原因是除了SO2和NO在煙氣中的初始濃度不同,還可能是。
③當(dāng)調(diào)節(jié)溶液初始pH由7升至12時(shí),通入煙氣后,NO轉(zhuǎn)化率由100%降為51%,可能的原因是。
(2)有氧條件下,NO在催化劑作用下可被NH3還原為N2。在釩基催化劑(V2O5)作用下的脫硝反應(yīng)機(jī)理如圖1所示。
①根據(jù)圖1機(jī)理,NO、NH3在有氧條件下的總化學(xué)方程式是。
②按上述圖1中NH3、NO和O2的比例進(jìn)行催化脫硝反應(yīng)。相同反應(yīng)時(shí)間,NH3和NO的轉(zhuǎn)化率與溫度的關(guān)系如圖2所示,200℃后,NO轉(zhuǎn)化率急劇下降的原因是。
(3)羥基自由基(HO?)也可以用于脫硫脫硝。圖3表示光催化氧化技術(shù)可生成HO?:光照時(shí),價(jià)帶失去電子產(chǎn)生有強(qiáng)氧化性的空穴,價(jià)帶上生成HO?;描述產(chǎn)生HO?的另一種過程:。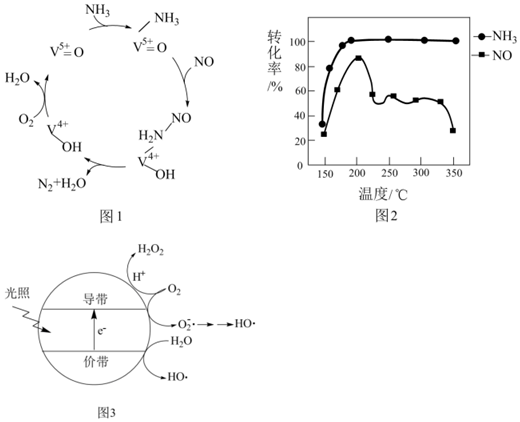 組卷:27引用:1難度:0.6
組卷:27引用:1難度:0.6


