2022-2023學年江蘇省南通市海安實驗中學高三(上)月考化學試卷(9月份)
發(fā)布:2024/12/31 20:0:3
一、單項選擇題:本題包括13小題,每小題3分,共計39分。每小題只有一個選項符合題意。
-
1.化學與能源開發(fā)、環(huán)境保護、資源利用等密切相關(guān).下列說法正確的是( )
A.實現(xiàn)化石燃料清潔利用,就無需開發(fā)新能源 B.垃圾是放錯地方的資源,應分類回收利用 C.綠色化學的核心是應用化學原理對環(huán)境污染進行治理 D.為提高農(nóng)作物的產(chǎn)量和質(zhì)量,應大量使用化肥和農(nóng)藥 組卷:5引用:3難度:0.7 -
2.H2S不僅能夠激活植物體內(nèi)的酶,清除羥基自由基(?OH)和H2O2等代謝產(chǎn)物,還能與Ca2+、NO、CO等信號分子相互作用:調(diào)控植物的生長發(fā)育。下列說法正確的是( )
A.固態(tài)H2O2屬于分子晶體 B.H2S為非極性分子 C.羥基自由基的電子式為: 
D.Ca2+的結(jié)構(gòu)示意圖為  組卷:24引用:2難度:0.7
組卷:24引用:2難度:0.7 -
3.下列關(guān)于物質(zhì)的性質(zhì)與用途具有對應關(guān)系的是( )
A.晶體硅熔點高硬度大,可用于制作半導體材料 B.常溫下鐵能與濃硫酸發(fā)生鈍化,可以用鐵制槽罐車運輸冷的濃硫酸 C.HF具有酸性,可用于雕刻玻璃 D.水玻璃顯弱堿性,可用于生產(chǎn)木材防火劑 組卷:3引用:2難度:0.8 -
4.閱讀下列材料,回答4~7題。
二氧化硫是一種重要的化工原料,可以制取硫酸、焦亞硫酸鈉等化工產(chǎn)品。其中,催化制取三氧化硫的熱化學方程式為:2SO2(g)+O2(g)?2SO3(g)ΔH=-196.6kJ?mol-1。二氧化硫也是形成酸雨的主要污染物,可以通過氨氣水溶液進行吸收。實驗室可以用濃硫酸與鋼加熱制取少量二氧化硫。
下列關(guān)于上述相關(guān)元素說法正確的是( )A.元素S在周期表中位于第三周期ⅣA族 B.第一電離能:I1(N)<I1(O) C.最高價氧化物對應的水化物的酸性:HNO3<H2SO3 D.元素Cu基態(tài)原子的電子排布式為[Ar]3d104s1 組卷:7引用:0難度:0.70
二、非選擇題(共61分)
-
16.高鐵酸鉀(K2FeO4)是優(yōu)良的水處理劑,呈紫色,可溶于水,難溶于乙醇;在0~5℃、強堿性溶液中比較穩(wěn)定,在酸性、中性溶液中易產(chǎn)生O2。某實驗小組以Cl2、FeCl3溶液和KOH溶液為原料制備K2FeO4并測定產(chǎn)品純度。

(1)取一定量FeCl3溶液和過量KOH溶液加入到圖示裝置的三頸燒瓶中,并控制瓶內(nèi)溫度維持在0~5℃。邊加熱圓底燒瓶邊滴加濃鹽酸(圖中加熱裝置省略未畫),直至三頸燒瓶內(nèi)呈現(xiàn)紫黑色,過濾,用95%乙醇洗滌晶體,干燥制得高鐵酸鉀產(chǎn)品。
①寫出三頸燒瓶中制備K2FeO4的化學反應方程式:。
②洗滌高鐵酸鉀晶體的實驗操作是。
③裝置圖中裝置X的作用是。
(2)上述實驗所需的FeCl3溶液,可以用鋁土礦(主要成分為Al2O3,含SiO2、Fe2O3、MgO雜質(zhì))為原料制取。請補充完整相應的實驗方案:邊攪拌邊向鋁土礦中加入1.0mol?L-1NaOH,。
已知:①該實驗中Al3+、Fe3+完全沉淀的pH分別為3.6、3.2,Mg2+開始沉淀的pH為9;②實驗中可選用的試劑:1.0mol?L-1HCl、1.0mol?L-1NaOH。
(3)測定K2FeO4的純度:
①準確稱取1.00g晶體,配成250mL溶液。
②準確量取25.00mLK2FeO4溶液放入錐形瓶,加入足量CrCl3和NaOH溶液,振蕩,再加入稀硫酸酸化后得Fe3+和Cr2O72-。
③滴入2滴二苯胺磺酸鈉作指示劑,用0.0500mol/L(NH4)2Fe(SO4)2標準溶液滴定至終點(反應方程式為:Cr2O72-+Fe2++H+→Cr3++Fe3++H2O,未配平),平行測定三次,平均消耗(NH4)2Fe(SO4)2標準溶液30.00mL。
計算樣品中K2FeO4的質(zhì)量分數(shù)(寫出計算過程)。組卷:16引用:1難度:0.5 -
17.某些工業(yè)廢水中含有鉈元素(Tl),其中三價鉈各物種的分布分數(shù)與pH的關(guān)系如圖1所示(已知:某物種的分布分數(shù)=
)。平衡時某物種的物質(zhì)的量各物種的物質(zhì)的量之和
(1)活性炭、鐵屑、鐵炭混合物、納米MnO2均可作為去除廢水中Tl+和Tl3+的吸附劑。
①相同條件下,分別使用活性炭、鐵屑、鐵屑+活性炭去除溶液中的鉈元素,效果如圖2所示。單獨使用活性炭時,也能除去少量鉈元素,原因是。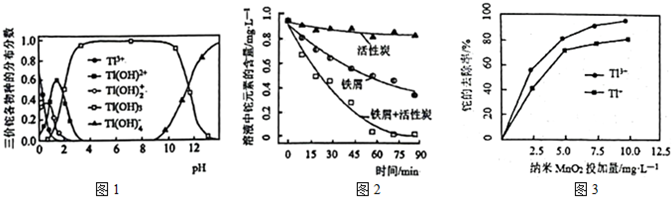
相同條件下,使用鐵屑+活性炭去除鉈元素的效果遠好于單獨使用活性炭和單獨使用鐵屑的效果總和。鐵屑+活性炭去除鉈元素的原理可以描述為:。
②用納米MnO2去除水體中的鉈元素,測得鉈的去除率隨MnO2投加量的變化關(guān)系如圖3所示。在納米MnO2用量不變的情況下,欲提高Tl+的去除效果,可采取的措施是。
(2)通過沉淀法也可以去除工業(yè)廢水中的Tl+和Tl3+。
①對于僅含有Tl+的廢水,常用硫酸鹽還原菌(SRB)的催化作用,將有機碳源(以CH2O表示)、SO42-、Tl+一起除去,原理如圖4所示。該圖示對應總反應的離子方程式為:。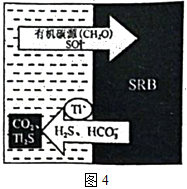
②向含鉈廢水中加入溴水,使Tl+充分氧化成Tl3+,再調(diào)節(jié)溶液pH沉淀鉈元素。當pH>8.9時,鉈元素去除率下降,原因可能是。組卷:15引用:1難度:0.6


