2023-2024學年河北省秦皇島市青龍實驗中學高二(上)開學化學試卷
發布:2024/8/23 5:0:1
一、選擇題(共14小題,每小題3分,共42分。每小題只有一個選項符合題意)
-
1.陜西歷史博物館收藏和展出了陜西歷史文化和中國古代文明中的諸多歷史文物.以下文物的主要構成材料不是金屬材料的是( )
A. 
朱雀銅熏爐B. 
青瓷罐C. 
銀臥鹿D. 
金怪獸組卷:23引用:3難度:0.7 -
2.化學反應A2+B2═2AB的能量變化如圖所示,則下列說法正確的是( )
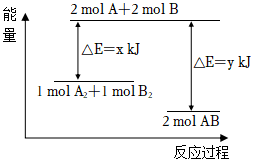
A.1mol A2和1mol B2完全反應吸收(y-x)kJ熱量 B.斷裂1mol A-A鍵和1mol B-B鍵放出xkJ的能量 C.斷裂2mol A-B鍵需要吸收ykJ的能量 D.2mol AB的總能量高于1mol A2和1mol B2的總能量 組卷:95引用:6難度:0.6 -
3.下列各組離子一定能大量共存的是( )
A.H+、Fe2+、SO42-、NO3- B.Fe3+、NH4+、Cl-、SCN- C.NH4+、Al3+、OH-、SO42- D.Na+、K+、NO3-、CO32- 組卷:46引用:3難度:0.6 -
4.下列說法正確的是( )
A.甲烷和Cl2的反應與乙烯和Br2的反應屬于同一有機反應類型 B.單質硅是將太陽能轉化為電能的常用材料 C.淀粉、纖維素和油脂都屬于天然高分子化合物 D.合成纖維和光導纖維都是新型無機非金屬材料 組卷:46引用:4難度:0.9 -
5.下列關于氯水的敘述正確的是( )
A.新制氯水可使有色布條褪色 B.新制氯水中只有Cl2和H2O分子 C.光照氯水有氣泡逸出,該氣體是Cl2 D.新制氯水放置一段時間后pH增大 組卷:70引用:1難度:0.5 -
6.有關 Fe2O3及硫酸鹽的內容,以下敘述正確的是( )
A.鋁熱劑就是指 Fe2O3 粉和鋁粉的混合物 B.檢驗從火星上帶回來的紅色物質是否是 Fe2O3的操作步驟是:樣品→粉碎→加水→溶解→過濾→向 濾液中滴加 KSCN 溶液 C.分別還原 a mol Fe2O3所需 H2、Al、CO 的物質的量之比為 3:2:3 D.明礬屬硫酸鹽,含結晶水,是混合物 組卷:12引用:2難度:0.7
三、填空題(本題包括4個小題,共58分)
-
17.含氮化合物的制備、應用及污染治理是科學研究領域的熱點問題。試回答下列問題。
(1)反應2CO(g)+2NO(g)?N2(g)+2CO2(g)ΔH=-620.9kJ?mol-1。可有效降低汽車尾氣污染物的排放。
①對于該反應,下列說法正確的是(填序號)。
A.該反應在高溫條件下可自發進行
B.容積固定的絕熱容器中,溫度保持不變時反應達到平衡狀態
C.投料比[即]越大,NO轉化率、反應速率均越大n(CO)n(NO)
D.在恒溫恒壓的容器中達平衡時,同時通入等物質的量的C?和CO2平衡不移動
②圖中曲線表示在其他條件一定時反應速率與溫度的關系,x為C?的轉化率,其中最佳反應溫度曲線為不同轉化率下最大反應速率與溫度的關系,則x最小的是下,理由是。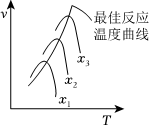
(2)我國科學家結合實驗與計算機模擬結果,得到在銅催化作用下將一個N,N-二甲基甲酞胺[(CH3)2NCHO]轉化為三甲胺[N(CH3)3]的合成路線。反應歷程如圖所示。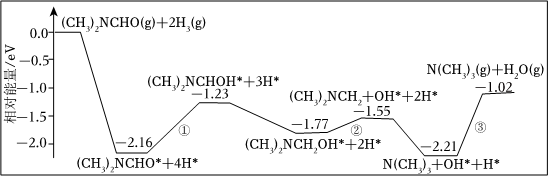
則反應( CH3)2NCHO(g)+2H2(g)═N(CH3)s(g)+H2O(g)的ΔH=kJ?mol-1(1eV=1.6×10-22kJ,NA的數值為6.02×1023,結果保留2位有效數字),①、②、③中反應速率最快的一步的化學方程式為。
(3)T℃時,存在如下平衡:2NO2(g)?N2O(g)。該反應正、逆反應速率與NO2、N2O4的濃度關系為v正=h正c2(NO2),v逆=k逆c(N2O4) (k正、k逆是速率常數),且lgv正~lgc(NO2)與lgv逆~lgc(N2O4)的關系如圖所示。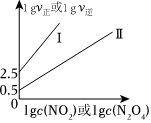
①圖中表示lgv逆~lgc(N2O4)的線是(填“I”或“II”)。
②T℃時,該反應的平衡常數K=L/mol。
③T℃時,向2L恒容密閉容器中充入1.6molNO2,某時刻v正=4×100.5mol/(L?min),則此時NO2的轉化率為。組卷:133引用:4難度:0.7 -
18.氮及其化合物如NH3及銨鹽、N2H4、N2O4等在中學化學、化工工業、國防等領域占有重要地位。
(1)發射航天火箭常用肼(N2H4)與N2O4作燃料與助燃劑。肼(N2H4)與N2O4的反應為2N2H4(1)+N2O4(g)=3N2(g)+4H2O(g)ΔH=-1077kJ/mol。已知相關反應的化學鍵鍵能數據如表:
則使1mol N2O4(g)分子中化學鍵完全斷裂時需要吸收的能量是化學鍵 N-H N-N N≡N O-H E/(kJ?mol-1) 390 190 946 460
(2)N2O4與NO2之間存在反應N2O4(g)?2NO2(g)。將一定量的N2O4放入恒容密閉容器中,測得其平衡轉化率[a(N2O4)]隨溫度的變化如圖1所示。
①由圖推測該反應ΔH0(填“>”或“<”),理由為
②圖中a點對應溫度下,已知N2O4的起始壓強p0為108kPa,列式計算該溫度下反應的平衡常數Kp=(用平衡分壓代替平衡濃度計算,分壓=總壓×物質的量分數)。
③在一定條件下,該反應N2O4、NO2的消耗速率與自身壓強間存在關系:v(N2O4)=k1p(N2O4),v(NO2)=k2p2(NO2),其中k1、k2是與反應溫度有關的常數。相應的速率一壓強關系如圖2所示,一定溫度下,k1、k2與平衡常數Kp的關系是k1=,在圖2標出的點中,能表示反應達到平衡狀態的點為。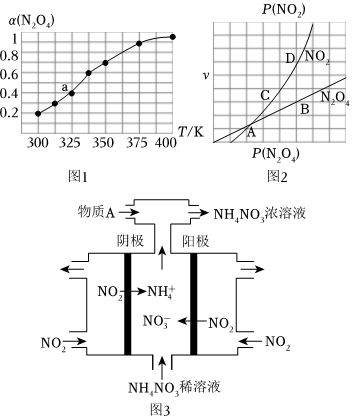
(3)電解NO2制備NH4NO3,其工作原理如圖3所示。
①陽極的電極反應式為。
②為使電解產物全部轉化為NH4NO3,需補充物質A,則A的化學式為。組卷:59引用:4難度:0.5


