2016-2017學年河北省滄州一中高二(上)開學化學試卷(A)
發布:2024/12/3 0:0:2
一、選擇題(本題包括30個小題,共60分.每小題只有一個答案符合題意)
-
1.膠體區別于其他分散系的本質特征是( )
A.膠體的分散質能通過濾紙空隙,而濁液的分散質不能 B.產生丁達爾現象 C.分散質粒子直徑在1nm~100nm之間 D.膠體在一定條件下能穩定存在 組卷:553引用:105難度:0.9 -
2.下列有關試劑的保存方法,錯誤的是( )
A.金屬鈉保存在煤油中 B.存放FeSO4溶液時加入少量鐵粉 C.NaOH溶液保存在帶橡膠塞的玻璃試劑瓶中 D.新制的氯水保存在無色細口瓶中 組卷:24引用:5難度:0.9 -
3.在無色的強堿性溶液中,能大量共存的是( )
A.Na+、Al3+、NO3-、Cl- B.K+、Na+、Cl-、AlO2- C.Fe2+、K+、SO42-、Cl- D.Na+、HCO3-、K+、NO3- 組卷:42引用:15難度:0.9 -
4.在a L Al2(SO4)3和(NH4)2SO4的混合溶液中加入b mol BaCl2,恰好使溶液中的SO42-離子完全沉淀;如加入足量強堿并加熱可得到c mol NH3,(已知NH4++OH-
NH3↑+H2O)則原溶液中的Al3+的物質的量濃度(mol?L-1)為( )△A. 2b-c2aB. 2b-caC. 2b-c3aD. 2b-c6a組卷:123引用:105難度:0.7 -
5.2.56gCu和一定量的濃HNO3反應,隨著Cu的不斷減少,反應生成氣體的顏色逐漸變淺,當Cu反應完畢時,共收集到氣體1.12L(標況),則反應消耗HNO3物質的量為( )
A.0.05 mol B.1mol C.0.13mol D.1.05mol 組卷:22引用:5難度:0.7 -
6.電子工業中常用FeCl3溶液腐蝕印刷電路板,欲從腐蝕后的廢液中回收Cu及制取純凈的FeCl3溶液,需要下列試劑:①蒸餾水②鐵粉 ③濃H2SO4 ④鹽酸⑤燒堿 ⑥濃氨水 ⑦Cl2 中的( )
A.②④⑦ B.①③④ C.②④⑥ D.④⑥⑦ 組卷:16引用:1難度:0.9 -
7.類推思維是化學解題中常用的一種思維方法,下列有關離子方程式的類推正確的是( )
已知 類推 A 將Fe加入CuSO4溶液中
Fe+Cu2+=Cu+Fe2+將Na加入到CuSO4溶液中
2Na+Cu2+=Cu+2Na+B 向稀硫酸加入NaOH溶液至中性
H++OH-=H2O向H2SO4溶液加入Ba(OH)2溶液至中性
H++OH-=H2OC 向氯化鋁溶液中加入足量NaOH溶液
Al3++4OH-=AlO2-+2H2O向氯化鋁溶液中加入足量氨水
Al3++4NH3?H2O=AlO2-+2H2O+4NH4+D 向Ca(OH)2溶液中通入過量CO2
CO2+OH-=HCO3-向Ca(OH)2溶液中通入過量SO2
SO2+OH-=HSO3-A.A B.B C.C D.D 組卷:69引用:21難度:0.7 -
8.ClO2是一種消毒殺菌效率高、二次污染小的水處理劑.實驗室可通過以下反應制得ClO2:2KClO3+H2C2O4+H2SO4=2ClO2↑+K2SO4+2CO2↑+2H2O 下列說法中正確的是( )
A.KClO3在反應中是還原劑 B.1molKClO3參加反應,在標準狀況下能得到22.4L氣體 C.反應中H2C2O4既不是氧化劑也不是還原劑 D.1molKClO3參加反應有1mol電子轉移 組卷:16引用:3難度:0.7 -
9.下列各組氣體,經充分反應后,原來的氣體有剩余的是( )
A.1molNH3和 1molHCl混合 B.1mol NO和 0.5 molO2混合 C.1molSO2和 1 molH2S混合 D.等體積的NO和NO2被足量燒堿溶液吸收 組卷:3引用:1難度:0.7 -
10.下列表示對應化學反應的離子方程式正確的是( )
A.Na2O2溶于水產生O2:Na2O2+H2O=2Na++2OH-+O2↑ B.Fe(OH)3溶于氫碘酸:Fe(OH)3+3H+=Fe3++3H2O C.次氯酸鈣溶液中通入過量二氧化碳:Ca2++2ClO-+H2O+CO2=CaCO3↓+2HClO D.將一定量的Al片投入足量的NaOH溶液中:2Al+2OH-+2H2O=2 +3H2↑AlO-2組卷:1引用:1難度:0.7 -
11.已知適當條件下+7、+6、+4價錳的化合物都能和濃鹽酸反應制得氯氣且還原產物都是MnCl2.將6.32g KMnO4粉末加熱一段時間后收集到0.112L氣體(標準狀況,后同),冷卻后放入足量的濃鹽酸再加熱,又收集到VL黃綠色氣體,下列說法正確的是( )
A.V=2.24L B.參加反應的HCl為0.18mol C.無法確定最終生成含鉀化合物的數量是多少 D.6.32g KMnO4粉末若直接與足量濃鹽酸反應可得到2.24L Cl2 組卷:44引用:5難度:0.7
二、非選擇題(本題包括4個小題,共40分)
-
33.鹽酸、硫酸和硝酸是中學階段常見的“三大酸”.現就三大酸與金屬銅反應的情況,回答下列問題:
(1)稀鹽酸不與Cu反應,若在稀鹽酸中加入H2O2(常見氧化劑,作氧化劑時還原產物為水)后,則可使銅順利溶解.該反應的化學方程式為:.
(2)在一定體積的10mol?L-1的濃硫酸中加入過量銅片,加熱使之反應,被還原的硫酸為0.9mol.則濃硫酸的實際體積(填“大于”、“等于”或“小于”)180mL.若使剩余的銅片繼續溶解,可在其中加入硝酸鹽溶液(如KNO3溶液),則該反應的離子方程式為.
(3)鎂鐵混合物4.9g,溶解在過量的某濃度的稀硝酸中,完全反應后得到標準狀況下2.24L NO 氣體.若向反應后的溶液中加入足量的燒堿,則可生成沉淀的質量是.組卷:12引用:3難度:0.5 -
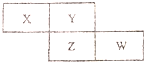 34.X、Y、Z、W四種短周期元素在周期表中的位置關系如圖:
34.X、Y、Z、W四種短周期元素在周期表中的位置關系如圖:
Ⅰ.若Y元素原子的最外層電子數是電子層數的3倍.
(1)W的原子結構示意圖為.
(2)一定條件下,X的最低價氫化物與X的某種氧化物按2:3物質的量比混合恰好反應生成X單質和水,該氧化物的化學式為.
(3)寫出銅片置于Z的最高價氧化物水化物稀溶液,沒有明顯變化.加熱,依然如故.再通入空氣,溶液就逐漸變藍,反應的離子方程式:.
II.若Y和Z的核外電子數之和為20.
(4)相對分子質量為28 的Y的氫化物電子式為
(5)W的一種單質溶于足量濃硝酸,反應過程轉移電子物質的量是該單質的20倍.反應的化學方程式:.
(6)X單質熔點2076℃.沸點3927℃,晶體硬度近似于金剛石,則X單質晶體屬于晶體;Z單質晶體結構與金剛石類似,晶體內化學鍵鍵角為.組卷:3引用:1難度:0.5


