2022年湖南師大附中高考化學模擬試卷(六)
發布:2024/4/20 14:35:0
一、單選題(每小題3分,共30分)
-
1.中國傳統文化對人類文明貢獻巨大,古代文獻中記載了古代化學研究成果。下列常見古詩文對應的化學知識正確的是( )
選項 古詩文 化學知識 A 《本草經集注》中記載鑒別硝石(KNO3)和樸硝(Na2SO4)的方法。“強燒之,紫青煙起,云是真硝石也。” 利用焰色反應 B 《本草綱目拾遺》中對強水的記載:“性最烈,能蝕五金,其水甚強,惟玻璃可盛” 強水為氫氟酸 C 《荀子?勸學》:“冰水為之,而寒于水。” 冰能量低于水,冰變為水屬于吸熱反應 D 《夢溪筆談》中對寶劍的記載:“古人以劑鋼為刃,柔鐵為莖干,不爾則多斷折” 鐵的合金硬度比純鐵的大,熔點比純鐵的高 A.A B.B C.C D.D 組卷:18引用:1難度:0.6 -
2.下列反應的離子方程式不正確的是( )
A.硝酸銀溶液中滴加過量氨水:Ag++2NH3?H2O═Ag(NH3)2++2H2O B.Na2SO3溶液用作脫氯劑:Cl2+SO32-+H2O═2H++2Cl-+SO42- C.向NH4HCO3溶液中滴入過量NaOH溶液:NH4++H++2OH-═NH3?H2O+H2O D.Na和CuSO4溶液反應:2Na+2H2O+Cu2+═Cu(OH)2↓+H2↑+2Na+ 組卷:20引用:1難度:0.7 -
3.NA代表阿伏加德羅常數的值,下列說法正確的是( )
A.17g-OH與17gOH-所含電子數目均為10NA B.常溫常壓下,44gN2O和CO2的混合氣體含有的原子總數為3NA C.常溫常壓下,40g SiC中所含C-Si鍵數目為2NA D.1L0.100mol?L-1的Na2CO3溶液中,陰離子數目為0.100NA 組卷:20引用:3難度:0.5 -
 4.如圖所示的兩種化合物可應用于阻燃材料和生物材料的合成。其中W、X、Y、Z為原子序數依次增大的短周期元素,X和Z同主族,Y原子序數為W原子最外層電子數的3倍。下列說法正確的是( )
4.如圖所示的兩種化合物可應用于阻燃材料和生物材料的合成。其中W、X、Y、Z為原子序數依次增大的短周期元素,X和Z同主族,Y原子序數為W原子最外層電子數的3倍。下列說法正確的是( )A.HZ的沸點高于HX的沸點 B.X和Z的最高化合價均為+7價 C.四種元素原子半徑由大到小的順序為Z>Y>W>X D.Z、W和氫三種元素可形成能促進水電離的離子化合物 組卷:27引用:2難度:0.7 -
5.下列實驗操作、實驗現象、解釋或結論都正確且有因果關系的是( )
選項 實驗操作 實驗現象 解釋或結論 A 向盛有2mL0.1mol?L-1AgNO3溶液的試管中滴加3mL0.1mol?L-1NaCl溶液,再向其中滴加一定量0.1mol?L-1KI溶液 先有白色沉淀生成,后又產生黃色沉淀 常溫下,溶度積:Ksp(AgCl)>Ksp(AgI) B 向NaBr溶液中加入過量氯水,再加入淀粉-KI溶液 溶液變藍 非金屬性:Cl>Br>I C 向某無色溶液中滴加濃鹽酸 產生氣體能使品紅溶液褪色 原溶液中一定含有 或SO2-3HSO-3D 向5mL0.1mol?L-1FeCl3溶液中滴加3mL0.1mol?L-1KI溶液,充分反應后,取少量反應后溶液于試管中,再滴入幾滴KSCN溶液 溶液變紅 KI與FeCl3的反應為可逆反應 A.A B.B C.C D.D 組卷:47引用:2難度:0.5 -
6.根據下列各圖曲線表征的信息,得出的結論錯誤的是( )

A.圖1表示常溫下向體積為10mL 0.1mol?L-1的NaOH溶液中逐滴加入0.1mol?L-1CH3COOH溶液后溶液的pH變化曲線,則c點處有c(CH3COOH)+2c(H+)=2c(OH-)+c(CH3COO-) B.圖2表示用水稀釋pH相同的鹽酸和醋酸時溶液的pH變化曲線,其中Ⅰ表示醋酸,Ⅱ表示鹽酸,且溶液導電性:c>b>a C.圖3表示H2與O2發生反應過程中的能量變化,表示H2燃燒熱的ΔH=-285.8kJ?mol-1 D.結合圖4分析可知,向100mL含Cu2+、Mn2+、Fe2+、Zn2+均為10-5mol/L的混合溶液中逐滴加入1×10-4mol/LNa2S溶液,Cu2+先沉淀 組卷:14引用:2難度:0.6
三、實驗題(13分)
-
17.減少氮的氧化物和碳的氧化物在大氣中的排放是環境保護的重要內容之一.
(1)已知:N2 (g)+O2 (g)=2NO (g)△H=+180.5kJ?mol-1
C(s)+O2 (g)=CO2 (g)△H=-393.5kJ?mol-1
2C (s)+O2(g)=2CO (g)△H=-221kJ?mol-1
若某反應的平衡常數表達式為:,c(N2)?c2(CO2)c2(NO)?c2(CO)
請寫出此反應的熱化學方程式.
(2)用CH4催化還原NOx可以消除污染,若將反應CH4+2NO2=CO2+2H2O+N2設計為原電池,電池內部是摻雜氧化釔的氧化鋯晶體,可以傳導O2-,則電池的正極反應式為.
(3)利用H2和CO2在一定條件下可以合成乙烯:6H2(g)+2CO2(g)CH2=CH2(g)+4H2O(g) 已知不同溫度對CO2的轉化率及催化劑的效率影響如圖所示,下列有關說法不正確的是催化劑(填序號).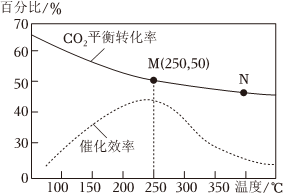
①不同條件下反應,N點的速率最大
②M點時平衡常數比N點時平衡常數大
③溫度低于250℃時,隨溫度升高乙烯的產率增大
④實際反應應盡可能在較低的溫度下進行,以提高CO2的轉化率
(4)在密閉容器中充入5mol CO和4mol NO,發生上述(1)中某反應,如圖為平衡時NO的體積分數與溫度、壓強的關系.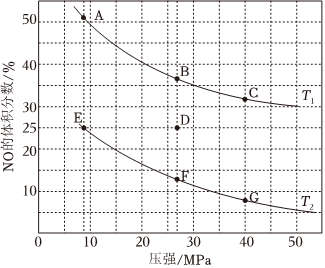
回答下列問題:
①溫度:T1T2(填“<”或“>”).
②某溫度下,若反應進行到10分鐘達到平衡狀態D點時,容器的體積為2L,則此時的平衡常數K=(結果精確到兩位小數);用CO的濃度變化表示的平均反應速率V(CO)=.
③若在D點對反應容器升溫的同時擴大體積至體系壓強減小,重新達到的平衡狀態可能是圖中A~G點中的點.組卷:44引用:6難度:0.3 -
18.某芳香烴X(分子式為C7H8)是一種重要的有機化工原料,研究部門以它為初始原料設計出如圖轉化關系圖(部分產物、合成路線、反應條件略去)。其中A是一氯代物。

已知:
Ⅰ. KMnO4
KMnO4
Ⅱ. Fe/HCl
Fe/HCl (苯胺,易被氧化)
(苯胺,易被氧化)
(1)F的名稱:,B→C的反應類型為;
(2)G中官能團的名稱為,反應②和③先后順序不能顛倒的原因是;
(3)寫出反應⑤的化學方程式:。
(4) 有多種同分異構體,其中所有滿足下列條件的同分異構體有 種。
有多種同分異構體,其中所有滿足下列條件的同分異構體有 種。
①遇FeCl3溶液顯紫色
②能發生銀鏡反應
③苯環上一氯代物只有2種。
(5)寫出由A轉化為 的合成路線 。(合成路線表示方法為:AB…反映試劑反應條件目標產物)。反映試劑反應條件組卷:124引用:1難度:0.5
的合成路線 。(合成路線表示方法為:AB…反映試劑反應條件目標產物)。反映試劑反應條件組卷:124引用:1難度:0.5


