2023-2024學年北京八中高三(上)期中化學練習試卷
發布:2024/10/10 6:0:3
本部分共14題,每小題3分,共42分.選出最符合題目要求的一項.
-
1.中國“天宮”空間站使用了很多高新技術材料.下列對涉及材料的說法不正確的是( )
A.核心艙的離子推進器使用氙氣作為推進劑,氙位于元素周期表0族 B.被譽為“百變金剛”的太空機械臂主要成分為鋁合金,其強度大于純鋁 C.“問天”實驗艙使用砷化鎵(GaAs)太陽能電池,砷和鎵位于元素周期表第四周期 D.太陽能電池翼基板采用碳纖維框架和玻璃纖維網,兩者均屬于有機高分子材料 組卷:86引用:5難度:0.5 -
2.下列圖示正確的是( )
A.3p電子的電子云輪廓圖: 
B.SO3的VSEPR模型: 
C.As的原子結構示意圖: 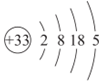
D.H-Cl的形成過程: 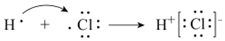 組卷:86引用:5難度:0.6
組卷:86引用:5難度:0.6 -
3.下列事實不能直接從原子結構角度解釋的是( )
A.化合物ICl中I為+1價 B.第一電離能:B>Al C.沸點:CS2>CO2 D.熱穩定性:NH3>PH3 組卷:106引用:8難度:0.7 -
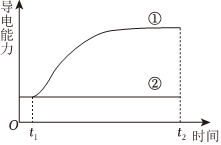 4.室溫下,t1時刻向兩個盛有50mL蒸餾水的燒杯中分別加入①1gCaCO3、②1g蔗糖,攪拌,最終分別得到懸濁液和澄清溶液,溶解過程中分散系的導電能力變化如圖。下列分析不正確的是( )
4.室溫下,t1時刻向兩個盛有50mL蒸餾水的燒杯中分別加入①1gCaCO3、②1g蔗糖,攪拌,最終分別得到懸濁液和澄清溶液,溶解過程中分散系的導電能力變化如圖。下列分析不正確的是( )A.該實驗可證明蔗糖不是電解質 B.該實驗可證明碳酸鈣是強電解質 C.當①中導電能力不變時,CaCO3(s)?Ca2+(aq)+ (aq)達到平衡CO2-3D.t2時刻,①中再加入1gCaCO3,導電能力不變 組卷:112引用:2難度:0.7 -
5.下列與事實對應的化學用語不正確的是( )
A.C和O形成CO2的過程: 
B.Na2CO3溶液處理水垢中的CaSO4:CaSO4+ ═CaCO3+CO2-3SO2-4C.0.1mol/LCHCH3COOH溶液的pH為3:CH3COOH?CH3COO-+H+ D.用石墨電極電解CuCl2溶液:Cu2++2Cl- Cu+Cl2↑電解組卷:22引用:1難度:0.5 -
6.下列關于實驗現象的解釋或所得結論正確的是( )
選項 實驗操作 現象 解釋或結論 A 向某補血口服液中滴加幾滴酸性KMnO4溶液 酸性KMnO4溶液紫色褪去 該補血口服液中一定含有Fe2+ B 用蒸餾水溶解CuCl2固體,并繼續加水稀釋 溶液由綠色逐漸變為藍色 [CuCl4]2-+4H2O?[Cu(H2O)4]2++4Cl-
正向移動C 將25℃0.1mol?L-1Na2SO3溶液加熱到40℃,用傳感器監測溶液pH變化 溶液的pH逐漸減小 溫度升高,Na2SO3水解平衡正向移動 D 將銅與濃硫酸反應產生的氣體通入BaCl2溶液中 產生白色沉淀 該氣體中一定含有SO2 A.A B.B C.C D.D 組卷:77引用:6難度:0.5
第二部分(非選擇題,共58分)
-
18.電化學還原CO2將其轉化為其它化學產品,是一種綜合利用CO2的好方法。
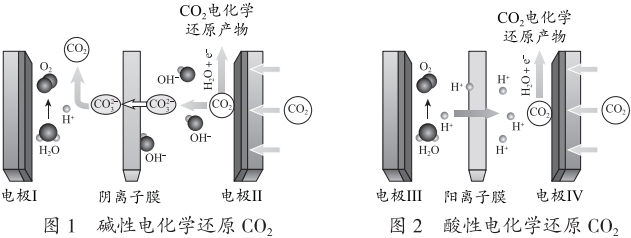
已知:選擇性(S)和法拉第效率(FE)的定義:
S(B)=×100%n(生成B所用的CO2)陰極吸收的CO2
FE(B)=×100%n(生成B所用的電子)n(通過電極的電子)
(1)堿性電化學還原CO2前,先在中性電解液中通電一段時間,pH及電流穩定后,再通CO2。在陰極區若CO2每得到1mol電子,同時H2O也會得到等物質的量的電子,且陰極區電解液的pH幾乎保持不變(忽略溶液體積變化)。
①補全陰極產生CH4的電極反應:CO2++═CH4+。
②陰極附近因為發生反應(用離子方程式表示),生成的難以放電,降低了S(CH4)。結合上述信息,S(CH4)的理論最大值為CO2-3。
③結合化學用語分析陽極區產生CO2的原因是。
(2)控制pH=1、電解液中存在KCl時,電化學還原CO2過程中CH4(其他含碳產物未標出)和H2的法拉第效率變化如圖3所示。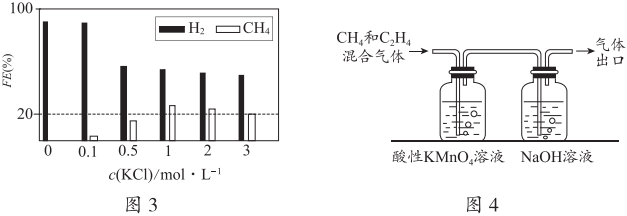
①結合圖3的變化規律,推測KCl可能的作用是。
②c(KCl)=3mol?L-1時,11.2L(已折合為標準狀況,下同)的CO2被完全吸收并還原為CH4和C2H4,分離H2后,將CH4和C2H4混合氣體通入如圖4所示裝置(反應完全),出口處收集到氣體6.72L,則FE(C2H4)為。組卷:102引用:4難度:0.5 -
19.某小組欲探究反應2Fe2++I2?2Fe3++2I-,完成如下實驗:
資料:如圖1,AgI是黃色固體,不溶于稀硝酸。新制的AgI見光會少量分解。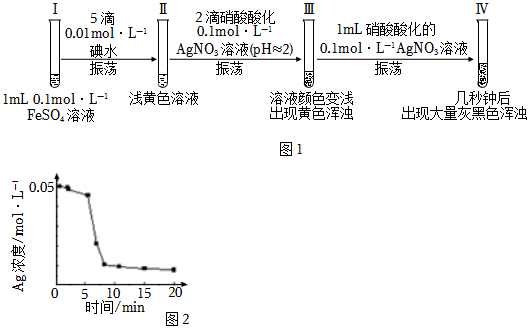
(1)Ⅰ、Ⅱ均未檢出Fe3+,檢驗Ⅱ中有無Fe3+的實驗操作及現象是:取少量Ⅱ中溶液,。
(2)Ⅲ中的黃色渾濁是。
(3)經檢驗,Ⅱ→Ⅲ的過程中產生了Fe3+。
①對Fe3+產生的原因做出如下假設:
假設a:空氣中存在O2,由于(用離子方程式表示),可產生Fe3+;
假設b:溶液中Ag+具有氧化性,可產生Fe3+;
假設c:;
假設d:該條件下,I2溶液可將Fe2+氧化為Fe3+。
②通過實驗進一步證實a、b、c不是產生Fe3+的主要原因,假設d成立。Ⅱ→Ⅲ的過程中I2溶液氧化Fe2+的原因是。
(4)經檢驗,Ⅳ中灰黑色渾濁中含有AgI和Ag。
①驗證灰黑色渾濁含有Ag的實驗操作及現象是:取洗凈后的灰黑色固體,。
②為探究Ⅲ→Ⅳ出現灰黑色渾濁的原因,完成了實驗1和實驗2。
實驗1:向1mL0.1mol?L-1FeSO4溶液中加入1mL0.1mol?L-1AgNO3溶液,開始時,溶液無明顯變化。幾分鐘后,出現大量灰黑色渾濁。反應過程中溫度幾乎無變化。測定溶液中Ag+濃度隨反應時間的變化如圖2。
實驗2:實驗開始時,先向試管中加入幾滴Fe2(SO4)3溶液,重復實驗1,實驗結果與實驗1相同。
ⅰ.實驗1中發生反應的離子方程式是。
ⅱ.Ⅳ中迅速出現灰黑色渾濁的可能的原因是。組卷:99引用:9難度:0.6


