2021-2022學年遼寧省沈陽十中高二(上)第一次月考化學試卷
發(fā)布:2024/9/15 0:0:8
一、選擇題(每道題有具只有一個正確答案,3分/共54分)
-
1.下列關于電解質(zhì)溶液的說法正確的是( )
A.0.1L0.5mol/LCH3COOH溶液中含有的H+數(shù)為0.05NA B.室溫下,稀釋0.1mol/LCH3COOH溶液的導電能力增強 C.0.1mol/LCH3COOH溶液中加入少量水,溶液中 減小c(H+)c(CH3COOH)D.CH3COOH溶液加水稀釋后,溶液中 減小c(CH3COOH)c(CH3COO-)組卷:3引用:1難度:0.7 -
2.下列事實一定能說明HNO2為弱電解質(zhì)的是( )
①常溫下,NaNO2溶液的pH>7
②用HNO2溶液做導電實驗燈泡很暗
③HNO2不能與NaCl反應
④常溫下0.1mol?L-1的HNO2溶液pH=2
⑤1L pH=1的HNO2溶液加水稀釋至100L后溶液的pH=2.2
⑥1L pH=1的HNO2和1L pH=1的鹽酸與足量的NaOH溶液完全反應,最終HNO2消耗的NaOH溶液多
⑦HNO2溶液中加入一定量NaNO2晶體,溶液中c(OH-)增大
⑧HNO2溶液中加水稀釋,溶液中c(OH-)增大.A.①②③⑦ B.①③④⑤ C.①④⑤⑥⑦ D.②④⑥⑧ 組卷:49引用:6難度:0.9 -
3.現(xiàn)有濃度均為0.1mol?L-1的鹽酸、硫酸、醋酸溶液。下列判斷正確的是( )
A.若三種溶液中c(H+)分別為a1mol?L-1、a2mol?L-1、a3mol?L-1,則它們的大小關系為 a1=a2=a312B.等體積的以上三種酸溶液分別與過量的NaOH溶液反應,若生成的鹽的物質(zhì)的量依次為b1mol、b2mol、b3mol,則它們的大小關系為b1=b2<b3 C.分別用以上三種酸溶液中和一定量的NaOH溶液生成正鹽,若需要酸溶液的體積分別為V1、V2、V3,其大小關系為V1=V2=V3 D.分別與Zn反應,開始時生成H2的速率分別為v1、v2、v3,其大小關系為v1>v2>v3 組卷:2引用:1難度:0.5 -
 4.pH是溶液中c(H+)的負對數(shù),若定義pC是溶液中微粒的物質(zhì)的量的負對數(shù),則常溫下,某濃度的草酸水溶液中pc(H2C2O4)、pc(HC2)、pc(C2O-4)隨溶液pH的變化曲線如圖所示。下列說法不正確的是( )O2-4
4.pH是溶液中c(H+)的負對數(shù),若定義pC是溶液中微粒的物質(zhì)的量的負對數(shù),則常溫下,某濃度的草酸水溶液中pc(H2C2O4)、pc(HC2)、pc(C2O-4)隨溶液pH的變化曲線如圖所示。下列說法不正確的是( )O2-4A.曲線1代表HC2 的濃度隨pH增大先變小后變大O-4B.草酸的Ka1=1×10-13,Ka2=1×10-4.3 C.pH=4時,c(HC2 )>c(C2O-4)>c(H2C2O4)O2-4D. =10-3C(C2O2-4)?C(H2C2O4)C2(HC2O4-)組卷:3引用:1難度:0.7 -
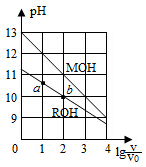 5.濃度均為0.10mol/L、體積均為V0的MOH和ROH溶液,分別加水稀釋至體積V,pH隨lg的變化如圖所示,下列敘述錯誤的是( )VV0
5.濃度均為0.10mol/L、體積均為V0的MOH和ROH溶液,分別加水稀釋至體積V,pH隨lg的變化如圖所示,下列敘述錯誤的是( )VV0A.MOH的堿性強于ROH的堿性 B.ROH的電離程度:b點大于a點 C.若兩溶液無限稀釋,則它們的c(OH-)相等 D.當lg =2時,若兩溶液同時升高溫度,則VV0增大c(M+)c(R+)組卷:2218引用:62難度:0.7 -
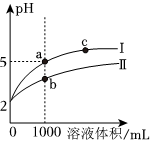 6.25℃時,pH=2的鹽酸和醋酸各1mL分別加水稀釋,pH隨溶液體積變化的曲線如圖所示。下列說法不正確的是( )
6.25℃時,pH=2的鹽酸和醋酸各1mL分別加水稀釋,pH隨溶液體積變化的曲線如圖所示。下列說法不正確的是( )A.曲線Ⅰ代表鹽酸的稀釋過程 B.a(chǎn)溶液的導電性比c溶液的導電性強 C.將a、b兩溶液加熱至30℃, 變小c(Cl-)c(CH3COO-)D.a(chǎn)溶液中和氫氧化鈉的能力強于b溶液 組卷:59引用:5難度:0.7 -
7.某溫度下,有pH相同的H2SO4溶液和Al2(SO4)3溶液,在H2SO4溶液中由水電離的H+濃度為10-amol/L,在Al2(SO4)3溶液中由水電離的H+濃度為10-bmol/L,則此溫度下的Kw為( )
A.1×10-14 B.1×10-2a C.1×10-(a+b) D.1×10-(7+a) 組卷:41引用:10難度:0.7
二、非選擇題(共三道題,共46分)
-
20.Ⅰ.現(xiàn)使用酸堿中和滴定法測定市售白醋的總酸量(g/100mL)。
實驗步驟:
(1)量取10.00mL食用白醋,在燒杯中用水稀釋后轉(zhuǎn)移到100mL(填儀器名稱)中定容,搖勻即得待測白醋溶液。
(2)用酸式滴定管取待測白醋溶液20.00mL于錐形瓶中,向其中滴加2滴作指示劑。
(3)讀取盛裝0.1000mol?L-1NaOH溶液的堿式滴定管的初始讀數(shù)。如果液面位置如圖所示,則此時的讀數(shù)為。
(4)數(shù)據(jù)記錄:
數(shù)據(jù)處理:食用白醋總酸量滴定次數(shù)
實驗數(shù)據(jù)/mL1 2 3 4 V(樣品) 20.00 20.00 20.00 20.00 V(NaOH)(消耗) 15.95 15.00 15.05 14.95 g/100mL
Ⅱ.莫爾法是一種沉淀滴定法,以K2CrO4為指示劑,用標準硝酸銀溶液滴定待測液,進而測定溶液中Cl-的濃度。已知:
(1)滴定終點的現(xiàn)象是銀鹽
性質(zhì)AgCl AgBr AgCN Ag2CrO4 AgSCN 顏色 白 淺黃 白 磚紅 白 溶解度(mol?L-1) 1.34×10-6 7.1×10-7 1.1×10-8 6.5×10-5 1.0×10-6 。
(2)若用AgNO3溶液滴定NaSCN溶液,可選為滴定指示劑的是。
A.NaCl
B.BaBr2
C.Na2CrO4
剛好達到滴定終點時,發(fā)生反應的離子方程式為。
Ⅲ.乙二酸(HOOC-COOH)俗名是一種有還原性的有機弱酸,在化學上有廣泛應用。
(1)小剛在做“研究溫度對化學反應速率的影響”實驗時,他往A、B兩支試管中均加入4mL0.01mol?L-1的酸性KMnO4溶液和2mL0.1mol?L-1H2C2O4(乙二酸)溶液,振蕩,A試管置于熱水中,B試管置于冷水中,記錄溶液褪色所需的時間。褪色所需時間tAtB(>或=”或“<”)。寫出該反應的離子方程式:。
(2)實驗室有一瓶混有泥沙的乙二酸樣品,小剛利用上述反應的原理來測定其含量,具體操作為:
①配制250mL溶液:準確稱量5.000g乙二酸樣品,配成250mL溶液。
②滴定:準確量取25.00mL所配溶液于錐形瓶中,加少量酸酸化,將0.1000mol?L-1KMnO4標準溶液裝入(填“酸式”或“堿式”)滴定管,進行滴定操作。下列操作會導致測定結(jié)果偏高的是。
A.未用KMnO4標準溶液潤洗滴定管
B.滴定錐形瓶內(nèi)有少量水
C.滴定前滴定管尖嘴部分有氣泡,滴定后氣泡消失
D.觀察讀數(shù)時,滴定前仰視,滴定后俯視組卷:14引用:1難度:0.5 -
21.納米ZnS具有獨特的光電效應,在電學、磁學、光學等領域應用廣泛。以工業(yè)廢渣鋅灰(主要成分為Zn、ZnO,還含有Fe2O3、FeO、CuO等雜質(zhì))為原料制備納米ZnS的工業(yè)流程如圖:

已知:Ksp[Fe(OH)3]=3.8×10-38;Ksp[Cu(OH)2]=2×10-20;Ksp(ZnS)=1.6×10-24
(1)酸浸時FeO反應的離子方程式為。
(2)再加入ZnO調(diào)節(jié)pH目的是。
(3)將酸浸的尾氣循環(huán)利用,加入的X氣體可以是。
(4)濾渣1的成分濾渣2中的成分。
(5)當溶液中Zn2+濃度小于1.0×10-5mol?L-1時,則可認為其沉淀完全。若要使Zn2+淀完全,溶液中S2-濃度應。組卷:7引用:1難度:0.5


