2020-2021學年湖北省荊州市沙市中學高二(上)期末化學試卷
發布:2024/12/19 9:30:7
一、選擇題(共14小題,每小題3分,滿分42分)
-
1.下列說法正確的是( )
A.強酸和強堿一定是強電解質,不論其水溶液濃度大小,都能完全電離 B.強電解質溶液的導電能力一定比弱電解質強 C.多元酸、多元堿的導電性一定比一元酸、一元堿的導電性強 D.強電解質不一定都是離子化合物 組卷:179引用:4難度:0.6 -
2.對于可逆反應N2(g)+3H2(g)?2NH3(g)△H<0,下列研究目的和示意圖相符的是( )
A B C D 研究目的 壓強對反應的影響(P2>P1) 溫度對反應的影響 平衡體系增加N2對反應的影響 催化劑對反應的影響 圖示 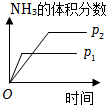
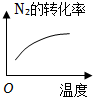
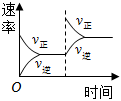
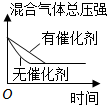
A.A B.B C.C D.D 組卷:421引用:84難度:0.9 -
3.下列說法或表示法正確的是( )
A.氫氣與氧氣反應生成等量的水蒸氣和液態水,前者放出熱量多 B.需要加熱的反應說明它是吸熱反應 C.在稀溶液中:H+(aq)+OH-(aq)═H2O(l)△H=-57.3kJ?mol-1,若將含0.5mol H2SO4的稀硫酸與含1mol NaOH的稀溶液混合,放出的熱量等于57.3kJ D.1mol S完全燃燒放熱297.3kJ,熱化學方程式為:S+O2═SO2 △H=297.3kJ?mol-1 組卷:41引用:3難度:0.5 -
4.在密閉容器中的一定量混合氣體發生反應:xA(g)+yB(g)?zC(g),達到平衡時,測得A的濃度為0.5mol?L-1,在溫度不變的條件下,將容器的體積擴大到兩倍,再達到平衡,測的A的濃度降低為0.35mol?L-1。下列有關判斷正確的是( )
A.x+y<z B.B的濃度增大 C.C的體積分數降低 D.平衡向逆反應方向移動 組卷:54引用:3難度:0.6 -
5.一定溫度下,水存在H2O?H++OH-的平衡,下列敘述一定正確的是( )
A.向水中滴入少量稀鹽酸,平衡逆向移動,Kw減小 B.將水加熱,Kw增大,pH減小 C.向水中加入少量固體NH4Cl,平衡逆向移動,c(H+)降低 D.向水中加入少量固體硫酸鈉,c(H+)=10-7mol/L,Kw不變 組卷:65引用:3難度:0.7 -
6.一定溫度下,在3個體積均為1.0L的恒容密閉容器中反應2H2(g)+CO(g)?CH3OH(g)達到平衡,下列說法正確的是( )
容器 溫度/k 物質的起始濃度/mol?L-1 物質的平衡濃度/mol?L-1 c(H2) c(CO) c(CH3OH) c(CH3OH) Ⅰ 400 0.20 0.10 0 0.080 Ⅱ 400 0.40 0.20 0 Ⅲ 500 0 0 0.10 0.025 A.該反應的正反應放熱 B.達到平衡時,容器Ⅰ中反應物轉化率比容器Ⅱ中的大 C.達到平衡時,容器Ⅱ中c(H2)大于容器Ⅲ中的兩倍 D.達到平衡時,容器Ⅲ中的正反應速率比容器Ⅰ中的大 組卷:62引用:42難度:0.5
二、填空題(共5小題,每小題17分,滿分58分)
-
18.已知25℃時,醋酸、氫硫酸、氫氰酸的電離平衡常數如下表:(單位省略)
(1)體積相同、c(H+)相同的三種酸溶液a。CH3COOH;b.HCN;c.H2SO4分別與同濃度的NaOH溶液完全中和,消耗NaOH溶液的體積由大到小的排列順序是(填字母)醋酸 氫硫酸 氫氰酸 Ka=1.8×10-5 Ka1=9.1×10-8 Ka2=1.1×10-12 Ka=4.9×10-10 。
(2)25℃時,等濃度的三種溶液①NaCN 溶液、②Na2S溶液、③CH3COONa溶液,pH由大到小的順序為(填序號)。
(3)25℃時,濃度均為0.01mol/L的①NaCN、②CH3COONa、③NaCl 溶液中,陰離子總濃度由大到小的順序為(填序號)。
(4)將濃度為0.02mol/L的HCN 與0.01mol/L NaOH 溶液等體積混合,測得混合溶液中c(Na+)>c(CN-),下列關系正確的是。
a.c(H+)<c(OH-)
b.c(H+)+c(HCN)=c(OH-)+c(CN-)
c.c(HCN)+c(CN-)=0.01mol/L
(5)25℃時,向NaCN溶液中通入少量H2S,反應的離子方程式為。組卷:36引用:3難度:0.7 -
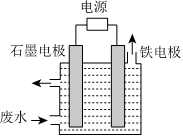 19.NaCN是一種重要的基本化工原料,同時也是一種劇毒物質,嚴重危害人類健康。含氰廢水中的氰化物常以[Fe(CN)6]3-和CN-的形式存在,工業上有多種廢水處理方法。其中電解處理法如圖。用如圖所示裝置處理含CN-廢水時,控制溶液pH為9~10并加入一定量的NaCl,一定條件下電解,陽極產生的ClO-將CN-氧化為無害物質而除去。鐵電極為 (填“陰極”或“陽極”),陽極產生的ClO-的電極反應為,陽極產生的ClO-將CN-氧化為無害物質而除去的離子方程式為。組卷:86引用:3難度:0.7
19.NaCN是一種重要的基本化工原料,同時也是一種劇毒物質,嚴重危害人類健康。含氰廢水中的氰化物常以[Fe(CN)6]3-和CN-的形式存在,工業上有多種廢水處理方法。其中電解處理法如圖。用如圖所示裝置處理含CN-廢水時,控制溶液pH為9~10并加入一定量的NaCl,一定條件下電解,陽極產生的ClO-將CN-氧化為無害物質而除去。鐵電極為 (填“陰極”或“陽極”),陽極產生的ClO-的電極反應為,陽極產生的ClO-將CN-氧化為無害物質而除去的離子方程式為。組卷:86引用:3難度:0.7


