2021-2022學年福建省泉州市晉江一中高二(上)期中化學試卷
發布:2024/11/23 7:30:1
一、選擇題(本題共15小題,1-5每小題2分,6-15每小題2分,共40分)
-
1.下列說法正確的是( )
A.放熱反應一定是自發進行的反應 B.吸熱反應一定是非自發進行的 C.自發進行的反應一定容易發生 D.有些吸熱反應也能自發進行 組卷:72引用:10難度:0.9 -
2.某反應過程中能量變化如圖所示,下列有關敘述正確的是( )
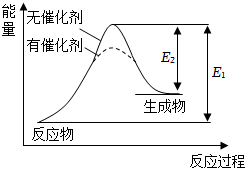
A.該反應為放熱反應 B.催化劑能夠增大反應體系中活化分子的百分數,升高溫度和增大壓強也能 C.催化劑改變了化學反應過程,所以改變了化學反應的熱效應 D.催化劑降低了反應的活化能,從而改變了化學反應速率 組卷:29引用:5難度:0.6 -
3.下列表述不正確的是( )
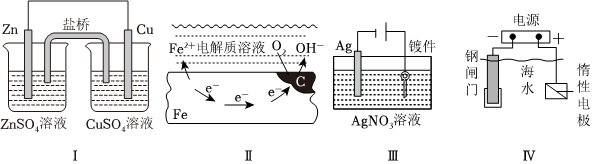
A.Ⅰ裝置中鹽橋中的Cl-移向ZnSO4溶液 B.Ⅱ中正極反應式為O2+4e-+2H2O=4OH- C.Ⅲ裝置模擬工業上在鍍件上鍍銀 D.Ⅳ裝置可以達到保護鋼閘門的目的 組卷:6引用:2難度:0.5 -
4.下列說法正確的是( )
A.已知25℃、101kPa條件下:4Al(s)+3O2(g)=2Al2O3(s) ΔH=-2834.9kJ/mol;4Al(s)+2O3(g)=2Al2O3(s)△H=-3119.1kJ?mol-1,則O3比O2穩定 B.已知CO(g)的標準燃燒熱:ΔH=-283.0kJ?mol-1,則2CO2(g)=2CO(g)+O2(g) ΔH=+566.0kJ?mol-1 C.已知中和熱為57.3kJ/mol,則反應H2SO4(aq)+Ba(OH)2(aq)=2H2O(l)+BaSO4(s) 的ΔH=-114.6kJ/mol D.在一定溫度和壓強下,將0.5molN2和1.5molH2置于密閉容器中充分反應生成NH3(g),放出熱量19.3kJ,則其熱化學方程式為N2(g)+3H2(g)?2NH3(g)ΔH=-38.6kJ/mol 組卷:8引用:2難度:0.9 -
5.往某恒溫密閉容器中加入CaCO3,發生反應:CaCO3(s)?CaO(s)+CO2(g)△H>0反應達到平衡后,縮小容器體積,重新達到平衡后,下列選項中值變大的是( )
A.c(CO2) B.m(CaCO3) C.m(CO2) D.m(CaO) 組卷:3引用:1難度:0.5 -
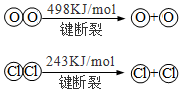 6.用Cl2生產某些含氯有機物時會產生副產物HCl.利用如下反應,可實現氯的循環利用:
6.用Cl2生產某些含氯有機物時會產生副產物HCl.利用如下反應,可實現氯的循環利用:
4HCl(g)+O2(g)=2Cl2(g)+2H2O(g)△H=-115.6 kJ?mol-1
下列說法正確的是( )A.升高溫度能提高HCl的轉化率 B.加入催化劑,能使該反應的焓變減小 C.1molCl2轉化為2molCl原子放出243kJ熱量 D.斷裂H2O(g)中1mol H-O鍵比斷裂HCl(g)中1mol H-Cl鍵所需能量高 組卷:186引用:8難度:0.9
二、填空題(本題共4小題,共60分)
-
 18.在容積為10L的密閉容器中,進行如下反應:A(g)+2B(g)?C(g)+D(g),最初加入1.0molA和2.2molB,在不同溫度下,D的物質的量n(D)和時間t的關系如圖,試回答下列問題:
18.在容積為10L的密閉容器中,進行如下反應:A(g)+2B(g)?C(g)+D(g),最初加入1.0molA和2.2molB,在不同溫度下,D的物質的量n(D)和時間t的關系如圖,試回答下列問題:
(1)800℃時,0~5min內,以B表示的平均反應速率為。
(2)能判斷反應達到化學平衡狀態的依據是(填字母)。
A.容器中壓強不變
B.混合氣體中c(A)不變
C.v正(B)=2v逆(D)
D.c(A)=c(C)
(3)若最初加入1.0molA和2.2molB,利用圖中數據計算800℃時的平衡常數K=,該反應為反應(填“吸熱”或“放熱”)。
(4)已知2CH3OH(g)?CH3OCH3(g)+H2O(g)在不同溫度下的平衡常數:400℃,K=32;500℃,K=44。已知在密閉容器中,測得某時刻各組分的濃度如下:
①判斷該反應的ΔH0(填“>”、“<”或“=”)。
②已知,某時刻數據如圖所示,平衡時,若以甲醇百分含量為縱坐標,以溫度為橫坐標,此時的反應點在圖象的位置是圖中點,比較圖中B、D兩點所對應的正反應速率BD(填“>”、“<”或“=”)。你判斷的理由是。物質 CH3OH(g) CH3OCH3(g) H2O(g) 濃度/(mol?L-1) 0.54 068 0.68 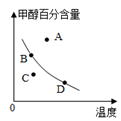 組卷:5引用:1難度:0.5
組卷:5引用:1難度:0.5 -
19.Ⅰ.工業上可用CO或CO2來生產燃料甲醇。已知甲醇制備的有關化學反應以及在不同溫度下的化學反應平衡常數如下表所示:
(1)據反應①與②可推導出K1、K2與K3之間的關系,則K3=化學反應 平衡常數 溫度/℃ 500 800 ①2H2(g)+CO(g)?CH3OH(g) K1 2.5 0.15 ②H2(g)+CO2(g)?H2O(g)+CO(g) K2 1.0 2.50 ③3H2(g)+CO2(g)?CH3OH(g)+H2O(g) K3 (用K1、K2表示)。500℃時測得反應③在某時刻,H2(g)、CO2(g)、CH3OH(g)、H2O(g)的濃度(mol?L-1)分別為0.8、0.1、0.3、0.15,則此時v正v逆(填“>”、“=”或“<”)。
(2)在3L容積可變的密閉容器中發生反應②,已知c(CO)-反應時間t變化曲線Ⅰ如圖1所示,若在t0時刻分別改變一個條件,曲線Ⅰ變為曲線Ⅱ和曲線Ⅲ。當曲線Ⅰ變為曲線Ⅱ時,改變的條件是。當曲線Ⅰ變為曲線Ⅲ時,改變的條件是。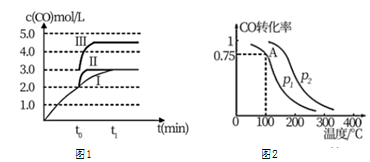
Ⅱ.利用CO和H2可以合成甲醇,反應原理為CO(g)+2H2(g)?CH3OH(g)。一定條件下,在容積為VL的密閉容器中充入amolCO與2amolH2合成甲醇,平衡轉化率與溫度、壓強的關系如圖2所示。
(3)p1p2(填“>”、“<”或“=”),理由是。
(4)該甲醇合成反應在A點的平衡常數K=(用a和V表示)。
(5)該反應達到平衡時,反應物轉化率的關系是COH2。(填“>”、“<”或“=”)
(6)下列措施中能夠同時滿足增大反應速率和提高CO轉化率的是(填字母)。
A.使用高效催化劑
B.降低反應溫度
C.增大體系壓強
D.不斷將CH3OH從反應混合物中分離出來組卷:12引用:1難度:0.5


