2020-2021學年河北省張家口市高二(上)期末化學試卷
發布:2024/12/28 9:30:2
一、選擇題(本題包括10個小題。每小題只有一個正確選項)
-
1.下列物質中,屬于弱電解質的是( )
A.氨水 B.二氧化硫 C.碳酸鈣 D.氟化氫 組卷:19引用:3難度:0.9 -
2.3.25g鋅與100mL1mol?L-1稀硫酸反應,為加快反應速率而不改變H2的產量,可采取的措施是( )
A.滴加幾滴濃鹽酸 B.滴加幾滴濃硝酸 C.滴加幾滴硫酸銅溶液 D.加入少量鋅粒 組卷:32引用:7難度:0.7 -
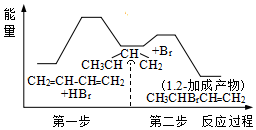 3.1,3-丁二烯(CH2=CH-CH=CH2)與HBr發生1,2-加成反應分兩步進行:第一步H+進攻1,3-T二烯生成碳正離子(
3.1,3-丁二烯(CH2=CH-CH=CH2)與HBr發生1,2-加成反應分兩步進行:第一步H+進攻1,3-T二烯生成碳正離子(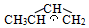 );第二步Br-進攻碳正離子完成1,2-加成反應,反應過程中的能量變化如下圖所示。下列說法正確的是( )
);第二步Br-進攻碳正離子完成1,2-加成反應,反應過程中的能量變化如下圖所示。下列說法正確的是( )A.兩步均為吸熱反應 B.該總反應為放熱反應 C.第一步反應速率大于第二步反應速率 D.加入催化劑可以改變該反應的反應熱 組卷:23引用:2難度:0.5 -
4.有關下列裝置的敘述正確的是( )
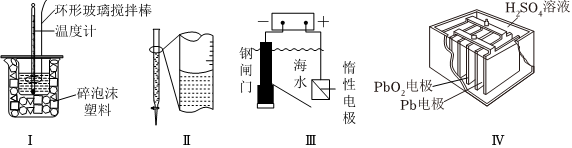
A.裝置I中碎泡沫塑料僅起支撐作用 B.裝置Ⅱ為酸式滴定管,其讀數為12.20mL C.裝置Ⅲ為犧牲陽極的陰極保護法 D.裝置Ⅳ為鉛蓄電池,其負極反應式為Pb-2e-+ ═PbSO4SO2-4組卷:15引用:6難度:0.7 -
5.下列說法正確的是( )
A.需要加熱才能發生的化學反應一定屬于吸熱反應 B.太陽能、氫能、風能、核能、地熱能都屬于資源豐富、可以再生的未來新能源 C.反應2A(g)+B(g)═3C(s)+D(g)在一定條件下能自發進行,則該反應的△H<0 D.已知:2H2(g)+O2(g)═2H2O(g)△H=-483.6kJ?mol-1,則氫氣的燃燒熱△H>-241.8kJ?mol-1 組卷:5引用:3難度:0.5 -
6.下列事實或操作與鹽類水解無關的是( )
A.明礬凈水 B.泡沫滅火器滅火 C.電解氯化鈉溶液制備氫氧化鈉 D.氯化銨溶液除鐵銹 組卷:24引用:3難度:0.4
三、填空題(本題包括4小題)
-
19.亞氯酸鈉(NaClO2)是一種高效漂白劑,主要用于棉紡、亞麻、紙漿的漂白及殺菌滅藻、魚藥制造。某科研小組欲制備少量亞氯酸鈉并利用“間接碘量法”測定其純度。
(一)亞氯酸鈉的制備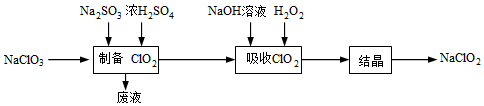
查閱資料:①NaClO2飽和溶液在溫度低于38℃時析出的晶體是NaClO2?3H2O,高于38℃時析出的晶體是NaClO2,高于60℃時NaClO2分解成NaClO3和NaCl;
②ClO2-+4I-+4H+═2H2O+2I2+Cl-,I2+2S2O32-═S4O62-+2I-。
(1)科研小組利用上述流程制備亞氯酸鈉,“吸收ClO2”時發生反應的化學方程式為。
(2)“結晶”需要控制的溫度范圍是。
(二)亞氯酸鈉純度的測定
Ⅰ.取制備的亞氯酸鈉固體7.5 g配制成250 mL溶液;
Ⅱ.取上述溶液25.00mL于錐形瓶中,加入足量KI溶液和稀H2SO4,再滴加幾滴試劑X;
Ⅲ.用1.50mol?L-1 Na2S2O3標準溶液滴定至終點,記錄消耗的Na2S2O3標準溶液的體積;
Ⅳ.重復Ⅱ、Ⅲ操作3次。
(3)試劑X應選擇(填名稱),滴定終點的現象為。
(4)三次滴定數據記錄如表:
亞氯酸鈉的純度為次數 1 2 3 V(Na2S2O3溶液)/mL 20.03 20.01 19.96 ,若滴定前滴定管內有氣泡,滴定后氣泡消失,會導致測定結果(填“偏低”“偏高”或“無影響”,下同),若滴定終點時俯視讀數會導致測定結果。組卷:6引用:3難度:0.5 -
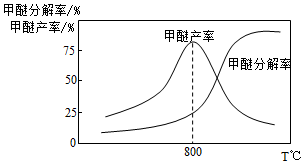 20.甲醇氣相脫水制甲醚的反應可表示為:2CH3OH(g)?CH3OCH3(g)+H2O(g),請回答下列問題:
20.甲醇氣相脫水制甲醚的反應可表示為:2CH3OH(g)?CH3OCH3(g)+H2O(g),請回答下列問題:
(1)一定溫度下,在恒容密閉容器中充入一定量的CH3OH(g)發生上述反應,能判斷反應達到化學平衡狀態的是。
a.CH3OCH3(g)和H2O(g)的濃度比保持不變
b.v正(CH3OH)=2v逆(CH3OCH3)
c.容器內壓強不再變化
d.混合氣體的平均相對分子質量不再變化
(2)200℃時,向恒容密閉容器中充入一定量的CH3OH(g)發生上述反應,測得CH3OH(g)的濃度隨時間(t)的變化如表:
①10~30min內,用CH3OCH3(g)表示該反應的平均速率為t/min 0 10 20 30 40 50 60 c(CH3OH)/(mol?L-1) 1.00 0.65 0.50 0.36 0.27 0.20 0.20 。
②CH3OH(g)的平衡轉化率為。
③反應開始時,容器內的壓強為p0,第40min末時容器內的壓強為p1,則p1:p0=;該反應在200℃時的平衡常數Kp=(以分壓表示,分壓=總壓×物質的量分數)。
④200℃時,向該容器中投入三種成分的濃度如下:
該時刻,正、逆反應速率的大小關系為:v正(CH3OH)物質 CH3OH(g) CH3OCH3(g) H2O(g) c/(mol?L-1) 0.54 0.68 0.68 v逆(CH3OH)(填“>”“<”或“=”)。
(3)已知:甲醚在一定條件下可分解為CO和H2,甲醚分解率、甲醇脫水制甲醚產率隨溫度變化關系如圖所示,試解釋800℃之后甲醇脫水制甲醚產率降低的原因為。組卷:24引用:6難度:0.7


