2020-2021學年四川省成都市蒲江中學高二(上)月考化學試卷(10月份)
發布:2024/4/20 14:35:0
一、選擇題(每小題只有一個答案,每題2分)
-
1.關于能源的利用,下列說法中錯誤的是( )
A.現在人類社會使用的能源主要是煤、石油和天然氣 B.能源的利用過程,實質上是能量的轉化和傳遞過程 C.由于我國煤和石油的儲量十分豐富,所以太陽能和核能的開發在我國并不十分重要 D.煤、石油和天然氣的化學能歸根到底來自太陽能 組卷:8引用:2難度:0.9 -
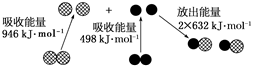
2.下列圖示變化為吸熱反應的是( )
A. 
B. 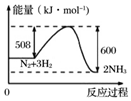
C. 
D.  組卷:71引用:12難度:0.6
組卷:71引用:12難度:0.6 -
 3.如圖為N2(g)和O2(g)反應生成NO(g)過程中的能量變化,則該反應的反應熱為( )
3.如圖為N2(g)和O2(g)反應生成NO(g)過程中的能量變化,則該反應的反應熱為( )A.-180 kJ?mol-1 B.+180 kJ?mol-1 C.+812 kJ?mol-1 D.-812 kJ?mol-1 組卷:3引用:1難度:0.7 -
4.下列熱化學方程式或離子方程式中,正確的是( )
A.0.01mol?L-1KAl(SO4)2溶液與0.02mol?L-1Ba(OH)2溶液等體積混合:Al3++2SO42-+2Ba2++3OH-═2BaSO4↓+Al(OH)3↓ B.一定條件下,將0.5mol N2(g)和1.5molH2(g)置于密閉的容器中充分反應生成NH3(g),放熱19.3kJ,熱化學方程式為:N2(g)+3H2(g)?2NH3(g)ΔH=-38.6kJ/mol C.2H2(g)+O2(g)═2H2O(g)ΔH=-571.6 kJ?mol-1,則H2的燃燒熱為285.8 kJ/mol D.CO(g)的燃燒熱是283.0 kJ?mol-1,則CO2分解的熱化學方程式為:2CO2(g)═2CO(g)+O2(g)ΔH=+566.0 kJ/mol 組卷:10引用:2難度:0.5 -
5.一定條件下,對于反應A2(g)+3B2(g)?2AB3(g)來說,下列所表示的化學反應速率中最大的是( )
A.v(A2)=0.8 mol/(L?s) B.v(A2)=6 mol/(L?min) C.v(AB3)=1.0 mol/(L?s) D.v(B2)=1.2 mol/(L?s) 組卷:35引用:4難度:0.5 -
6.在一定條件下,使SO2和O2在一密閉容器中進行反應,下列說法中不正確的是( )
A.反應開始時,正反應速率最大,逆反應速率為零 B.隨著反應的進行,正反應速率逐漸減小,最后為零 C.隨著反應的進行,逆反應速率逐漸增大,最后不變 D.隨著反應的進行,正反應速率逐漸減小,最后不變 組卷:409引用:7難度:0.6 -
7.下列熱化學方程式正確的是(注:△H的絕對值均正確)( )
A.C2H5OH(l)+3O2(g)═2CO2(g)+3H2O(g);△H=-1367.0 kJ/mol(燃燒熱) B.NaOH(aq)+HCl(aq)═NaCl(aq)+H2O(l);△H=-57.3kJ/mol(中和熱) C.S(s)+O2(g)═SO2(g);△H=+269.8kJ/mol(反應熱) D.2NO2═O2+2NO;△H=+116.2kJ/mol(反應熱) 組卷:86引用:12難度:0.5 -
8.已知1.2g C(石墨)不完全燃燒生成CO,放出11.1kJ熱量,繼續燃燒又放出28.3kJ熱量.則能表示C(石墨)燃燒熱的熱化學方程式為( )
A.C(石墨 s)+ O2(g)=CO(g)△H=-11.1kJ?mol-112B.C(石墨 s)+ O2(g)=CO(g)△H=-111kJ?mol-112C.C(石墨 s)+O2(g)=CO2(g)△H=-394kJ?mol-1 D.C(石墨 s)+O2(g)=CO2(g)△H=-283kJ?mol-1 組卷:14引用:2難度:0.9
二、填空題(共60分)
-
24.美國Bay等工廠使用石油熱裂解的副產物甲烷來制取氫氣,其生產流程如圖1:

(1)此流程的第Ⅱ步反應為:CO(g)+H2O(g)?H2(g)+CO2(g),該反應的化學平衡常數表達式為K=;反應的平衡常數隨溫度的變化如表:
從表可以推斷:此反應是溫度/℃ 400 500 830 1000 平衡常數K 10 9 1 (填“吸”或“放”)熱反應.在830℃下,若開始時向恒容密閉容器中充入CO與H2O均為1mol,則達到平衡后CO的轉化率為.
(2)在830℃,以下表的物質的量(單位為mol)投入恒容反應器發生上述第Ⅱ步反應,其中反應開始時,向正反應方向進行的有(填實驗編號);
(3)在一個不傳熱的固定容積的容器中,判斷此流程的第Ⅱ步反應達到平衡的標志是實驗編號 n(CO) n(H2O) n(H2) n(CO2) A 1 5 2 3 B 2 2 1 1 C 0.5 2 1 1 .
①體系的壓強不再發生變化②混合氣體的密度不變
③混合氣體的平均相對分子質量不變④各組分的物質的量濃度不再改變
⑤體系的溫度不再發生變化⑥v(CO2)正=v(H2O)逆
(4)圖2表示此流程的第Ⅱ步反應,在t1時刻達到平衡、在t2時刻因改變某個條件濃度發生變化的情況:圖中t2時刻發生改變的條件是(寫出兩種).組卷:9引用:4難度:0.5 -
25.用酸性KMnO4和H2C2O4(草酸)反應研究影響反應速率的因素,離子方程式為:2
+5H2C2O4+6H+═2Mn2++10CO2↑+8H2O.一實驗小組欲通過測定單位時間內生成CO2的速率,探究某種影響化學反應速率的因素,設計實驗方案如圖1所示(KMnO4溶液已酸化):MnO-4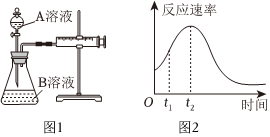
(1)該實驗探究的是實驗序號 A溶液 B溶液 ① 20mL 0.1mol?L-1H2C2O4溶液 30mL 0.01mol?L-1KMnO4溶液 ② 20mL 0.2mol?L-1H2C2O4溶液 30mL 0.01mol?L-1KMnO4溶液 因素對化學反應速率的影響.相同時間內針筒中所得CO2的體積大小關系是①②(填“>”、“<”或“=”).
(2)若實驗①在2min末收集了4.48mL CO2(標準狀況下),則在2min末,c()=MnO-4mol?L-1.(假設混合溶液體積為50mL)
(3)除通過測定一定時間內CO2的體積來比較反應速率,本實驗還可通過測定來比較化學反應速率.
(4)小組同學發現反應速率總是如圖2,其中t1~t2時間內速率變快的主要原因可能是:①產物Mn2+是反應的催化劑、②.組卷:19引用:8難度:0.5


