2022-2023學年北京市101中學高二(上)期中化學試卷(等級考)
發布:2024/4/20 14:35:0
一、(共14道小題,每小題只有一個選項符合題意,每小題3分。)
-
1.新中國化學題材郵票記載了我國化學的發展歷程,形象地呈現了人類與化學相互依存的關系。下列郵票內容所涉及的主要物質,屬于無機化合物的是( )
A B C D 



侯氏制堿法生產純堿 化學工業生產橡膠 齊魯三十萬噸乙烯工程 人工全合成結晶牛胰島素 A.A B.B C.C D.D 組卷:105引用:7難度:0.7 -
2.下列物質的應用中,利用了水解平衡的是( )
A.用NaHCO3固體制備純堿 B.用明礬[KAl(SO4)2?12H2O]處理污水 C.用鹽酸去除鐵銹(主要成分Fe2O3?xH2O) D.用雙氧水殺滅細菌 組卷:35引用:1難度:0.7 -
3.下列各組離子因發生氧化還原反應而不能大量共存的是( )
A.K+、H+、SO32-、Cl- B.H+、Fe2+、NO3-、SO42- C.Na+、Cu2+、Cl-、S2- D.Al3+、Na+、SO42-、HCO3- 組卷:28引用:1難度:0.7 -
4.Na2CO3俗稱純堿,是基本化工原料.下列涉及Na2CO3的方程式中,正確的是( )
A.Na2O2與CO2反應生成Na2CO3:Na2O2+CO2═Na2CO3+O2 B.Na2CO3溶液呈堿性:CO32-+H2O?H2CO3+OH- C.Na2CO3溶液除去CH3COOC2H5中的CH3COOH:CO32-+2H+═CO2↑+H2O D.飽和Na2CO3溶液處理水垢中的CaSO4:CO32-+CaSO4═CaCO3+SO42- 組卷:71引用:5難度:0.9 -
5.關于室溫下pH=11的NH3?H2O溶液,下列說法不正確的是( )
A.溶液中c(OH-)=1.0×10-3mol/L B.由水電離出的c(OH-)=1.0×10-11mol/L C.加水稀釋100倍后,一水合氨的電離程度增大 D.加入等體積pH=3的鹽酸充分反應后,溶液呈中性 組卷:37引用:2難度:0.7 -
 6.用0.1000mol/LHCl溶液滴定未知濃度的KOH溶液。有關該實驗說法中正確的是( )
6.用0.1000mol/LHCl溶液滴定未知濃度的KOH溶液。有關該實驗說法中正確的是( )A.用如圖中的a滴定管裝0.1000mol/LHCl溶液 B.滴定,需用未知濃度的KOH溶液潤洗錐形瓶2~3次 C.滴定時,眼睛要注視滴定管中液面的變化 D.滴定過程中,滴定管漏液,測量結果偏高 組卷:39引用:1難度:0.7
二、非選擇題(共58分)
-
18.某粗銅精煉得到的陽極泥主要成分為:Cu、Se、Ag2Se等,從中提取Se的工藝流程如圖:
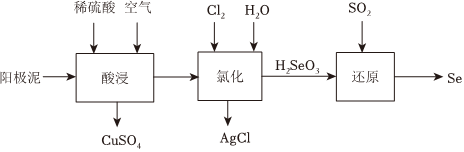
已知:
(1)酸浸過程,通入稀硫酸和空氣的目的是化學式 Ag2Se AgCl Ksp(常溫) 2.0×10-64 1.8×10-10 。
(2)“氯化”過程中發生如下轉化:
①Se轉化為H2SeO3,反應方程式為。
②Ag2Se轉化為AgCl,從化學平衡的角度解釋原因。
(3)“還原”過程中發生反應的化學方程式為。
(4)滴定法測定CuSO4溶液的濃度,其基本原理為:
第一步:2Cu2++4I-═2CuI↓+I2
第二步:2S2(無色)+I2═S4O2-3(無色)+2I-O2-6
①由此可知滴定所用的指示劑為。
②若CuSO4溶液體積為25mL,滴定至終點時消耗cmol/LNa2S2O3溶液VmL,則CuSO4溶液的物質的量濃度為mol/L。
③若第一步使用的KI溶液過量,對滴定結果的影響是。(填“偏大”或“偏小”或“不影響”)組卷:15引用:3難度:0.4 -
19.某同學在實驗室進行鐵鹽與亞鐵鹽相互轉化的實驗:
實驗Ⅰ:將Fe3+轉化為Fe2+
(1)Fe3+與Cu粉發生反應的離子方程式為。
(2)探究白色沉淀產生的原因:
補全實驗方案:①步驟1:實驗方案 現象 結論 步驟1:取4mL___mol/LCuSO4溶液,向其中滴加3滴0.1mol/LKSCN溶液 產生白色沉淀 CuSO4與KSCN反應產生了白色沉淀 步驟2:___ 無明顯現象 ;②步驟2:。
查閱資料:i.SCN-的化學性質與I-相似;
ii.2Cu2++4I-═2CuI↓+I2
③Cu2+與SCN-反應的離子方程式為。
實驗Ⅱ:將Fe2+轉化為Fe3+
探究上述現象出現的原因:實驗方案 現象 向3mL0.1mol/LFeSO4溶液中加入1mL8mol/L稀硝酸 溶液變為棕色,放置一段時間后,棕色消失,溶液變為黃色
查閱資料:Fe2++NO?Fe(NO)2+(棕色)
(3)用離子方程式解釋NO產生的原因。
(4)從化學反應速率與限度的角度對體系中存在的反應進行分析:
反應Ⅰ:Fe2+與HNO3反應;
反應Ⅱ:Fe2+與NO反應
①依據實驗現象,甲認為反應Ⅰ的速率比反應Ⅱ的速率(填“快”或“慢”)。
②乙認為反應I是一個不可逆反應,并通過實驗證明其猜測正確,乙設計的實驗方案是。
③請用化學平衡移動原理解釋溶液由棕色變為黃色的原因。組卷:10引用:1難度:0.5


