2021年甘肅省嘉峪關一中高考化學四模試卷
發布:2024/4/20 14:35:0
一、選擇題(本題包括20小題,1-10題每題2分,11-20題每題3分,每小題只有一個選項符合題意)
-
1.2018年是“2025中國制造”啟動年,而化學與生活、人類生產、社會可持續發展密切相關,下列有關化學知識的說法錯誤的是( )
A.高純度的二氧化硅廣泛用于制作光導纖維,光導纖維遇強堿會“斷路” B.用聚氯乙烯代替木材生產快餐盒,以減少木材的使用 C.碳納米管表面積大,可用作新型儲氫材料 D.銅導線和鋁導線纏繞連接處暴露在雨水中比在干燥環境中更快斷裂的主要原因是發生了電化學腐蝕 組卷:35引用:3難度:0.6 -
2.化學與生活、科技及環境密切相關。下列說法正確的是( )
A.二氧化氯泡騰片和酒精均可殺滅新型冠狀病毒,二者的消毒原理相同 B.高鐵“復興號”車廂連接關鍵部位所使用的增強聚四氟乙烯板屬于無機高分子材料 C.保持空氣濕度和適當降溫可減少新型冠狀病毒傳染,二者均可防止病毒滋生 D.蠟蛾幼蟲會啃食聚乙烯塑料袋,并能將其轉化為乙二醇,這項研究有助于減少白色污染 組卷:57引用:3難度:0.6 -
3.設NA為阿伏加德羅常數的數值,下列說法正確的是( )
A.1molNa2O2與水完全反應時轉移電子數為2NA B.標準狀況下,22.4LN2和H2混合氣中含2NA個原子 C.將NA個NH3分子溶于1L水中得到1mol?L-1的氨水 D.lmolNa2O2中共含有4NA個離子 組卷:9引用:1難度:0.8 -
4.下列表示正確的是( )
A.HClO的結構式 H-Cl-O B.CC14的電子式 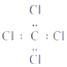
C.Na+離子的結構示意圖 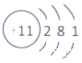
D.乙醇的球棍模型 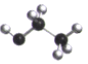 組卷:14引用:2難度:0.9
組卷:14引用:2難度:0.9 -
5.有a、b、c、d四種金屬。將a與b用導線接起來,浸入電解質溶液中,一段時間后a電極質量減小。將a、d分別投入等濃度的鹽酸中,d比a反應強烈。將銅浸入b的鹽溶液里,無明顯變化。如果把銅浸入c的鹽溶液里,有金屬c析出.據此判斷它們的活動性順序由強到弱的為( )
A.a>c>d>b B.d>b>a>c C.b>a>d>c D.d>a>b>c 組卷:10引用:2難度:0.7 -
6.在密閉容器中進行反應N2+3H2?2NH3(正反應為放熱反應)。下列說法正確的是( )
A.降低溫度能增大反應速率 B.保持體積不變,充入N2,能增大反應速率 C.達到平衡時,反應速率:v正=v逆=0 D.達到平衡時,N2和H2能100%轉化為NH3 組卷:5引用:2難度:0.7 -
7.如圖分別表示有關反應的反應過程與能量變化的關系。
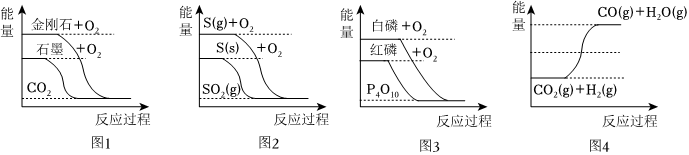
據此判斷下列說法中正確的是( )A.由圖1知,石墨轉變為金剛石是吸熱反應 B.由圖2知,S(g)+O2(g)═SO2(g) ΔH1,S(s)+O2(g)═SO2(g)ΔH2,則ΔH1>ΔH2 C.由圖3知,白磷比紅磷穩定 D.由圖4知,CO(g)+H2O(g)═CO2(g)+H2(g) ΔH>0 組卷:25引用:5難度:0.5 -
8.金屬元素鈁(Fr)在自然界中含量極少.它的21個已知同位素都有放射性.它是堿金屬元素中最重的元素.根據它在周期表中的位置預言其性質,其中不正確的是( )
A.在已知堿金屬元素中具有最大的原子半徑 B.其氧化物對應的水化物是極強的堿 C.在空氣中燃燒時生成氧化物Fr2O D.在已知堿金屬元素單質中熔點最低 組卷:34引用:3難度:0.7
二、非選擇題共50分
-
24.寫出或完成下列熱化學方程式。
(1)下列變化過程,屬于放熱反應的是。
①濃H2SO4稀釋;
②酸堿中和反應;
③H2在Cl2中燃燒;
④Ba(OH)2?8H2O與NH4Cl;
⑤鋁熱反應;
⑥碳高溫條件下還原CO2。
(2)0.5molCH4完全燃燒生成CO2和液態水時,放出445kJ的熱量。寫出CH4燃燒的熱化學方程式。
(3)通常人們把拆開1mol某化學鍵吸收的能量看成該化學鍵的鍵能。下表是一些化學鍵的鍵能。
根據鍵能數據估算下列反應:CH4(g)+4F2(g)=CF4(g)+4HF(g)的反應熱△H為化學鍵 C-H C-F H-F F-F 鍵能kJ/mol 414 489 565 155 。
(4)氫能的存儲是氫能利用的前提,科學家研究出一種儲氫合金Mg2Ni,已知:
①Mg(s)+H2(g)=MgH2(s)ΔH1
②Mg2Ni(s)+2MgH2(s)=2Mg(s)+Mg2NiH4(s)ΔH2
求Mg2Ni(s)+2H2(g)=Mg2NiH4(s)ΔH=。
(5)已知反應:N2(g)+3H2(g)?2NH3(g)△H=-92.2kJ/mol,現取1molN2(g)和3molH2(g)放在一密閉容器中,在催化劑存在時進行反應,測得反應放出的熱量92.2kJ(填“大于”“等于”或“小于”),原因是;組卷:17引用:1難度:0.6 -
25.回答下列問題:
(1)在80℃時,將0.40mol 的N2O4氣體充入2L已經抽空的固定容積的密閉容器中,發生如下反應:N2O4?2NO2 ΔH>0,隔一段時間對該容器內的物質進行分析,得到如下數據:
①計算20~40s 內用N2O4表示的平均反應速率為時間/s
物質 n/mol0 20 40 60 80 100 n(N2O4) 0.40 a 0.20 c d e n(NO2) 0.00 0.24 b 0.52 0.60 0.60 mol?L-1?s-1。
②反應進行至100s 后將反應混合物的溫度降低,混合氣體的顏色(填“變淺”“變深”或“不變”)。
③要增大該反應的K值,可采取的措施有(填序號)。
A.增大N2O4起始濃度
B.向混合氣體中通入NO2
C.使用高效催化劑
D.升高溫度
(2)已知2A2(g)+B2(g)?2C(g) ΔH=-akJ?mol-1(a>0),在一個有催化劑的固定容積的容器中加入2 molA2和1 molB2,在500℃時充分反應達到平衡后C的濃度為wmol?L-1,放出熱量bkJ。
①a(填“>”“=”或“<”)b。
②若將反應溫度升高到700℃,該反應的平衡常數將(填“增大”“減小”或“不變”)。
③若在原來的容器中,只加入2molC,500℃時充分反應達到平衡后,C的濃度(填“>”“=”或“<”)wmol?L-1。
④能說明該反應已經達到平衡狀態的是。
a.v(C)=2v(B2)
b.容器內壓強保持不變
c.v逆(A2)=2v正(B2)
d.容器內氣體的密度保持不變
⑤使該反應的反應速率增大,且平衡向正反應方向移動的操作是。
a.及時分離出C氣體
b.適當升高溫度
c.增大B2的濃度
d.選擇高效的催化劑組卷:6引用:2難度:0.4


