2022-2023學年新疆大學附中高三(上)期中化學試卷
發布:2025/1/6 5:30:2
一、題(每題6分,共42分)
-
1.草酸(分子式為H2C2O4,沸點:150℃)是生物體的一種代謝產物,廣泛分布于植物、動物和真菌體中。下列有關判斷不正確的是( )
A.45g草酸中含有1.204×1024個氧原子 B.1mol草酸中含有6.02×1023個分子 C.草酸的摩爾質量是90g?mol-1 D.1mol草酸在標準狀況下的體積約為22.4L 組卷:59引用:10難度:0.6 -
2.中華傳統文化蘊含著很多科學知識,下列說法錯誤的是 ( )
A.“水聲冰下咽,沙路雪中平“未涉及化學變化 B.“霾塵積聚難見路人“形容的霾塵中有氣溶膠,具有丁達爾效應 C.“試玉要燒三日滿,辨才須待七年期”,此文中“玉”的主要成分為硅酸鹽,該詩句表明玉的硬度很大 D.“自古書契多編以竹簡,其用縑帛者(絲織品)謂之為紙”,文中“紙”的主要成分是蛋白質 組卷:62引用:2難度:0.7 -
3.能正確表示下列反應的離子方程式為( )
A.硫化鈉溶液和硝酸混合:S2-+2H+═H2S↑ B.將等物質的量濃度的Ba(OH)2和NH4HSO4溶液以體積比1:2混合:Ba2++2OH-+2H++SO42-═BaSO4↓+2H2O C.硅酸鈉溶液中通入二氧化碳:SiO32-+CO2+H2O═HSiO3-+HCO3- D.明礬溶液與過量氨水混合:Al3++4NH3+2H2O═AlO2-+4NH4+ 組卷:95引用:6難度:0.7
二、非選擇題(共58分)
-
9.硫酸鋅(ZnSO4)是制備各種含鋅材料的原料,在防腐、電鍍、醫學上有諸多應用。硫酸鋅可由菱鋅礦制備,菱鋅礦的主要成分為ZnCO3,雜質為SiO2以及Ca、Mg、Fe、Cu等的化合物。其制備流程如圖:
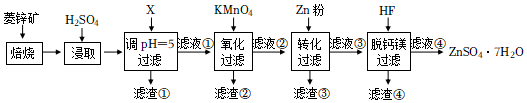
本題中所涉及離子的氫氧化物溶度積常數如下表:
回答下列問題:離子 Fe3+ Zn2+ Cu2+ Fe2+ Mg2+ Ksp 4.0×10-38 6.7×10-17 2.2×10-20 8.0×10-16 1.8×10-11
(1)菱鋅礦焙燒生成氧化鋅的化學方程式為。
(2)為了提高鋅的浸取效果,可采取的措施有、。
(3)加入物質X調溶液pH=5,最適宜使用的X是(填標號)。
A.NH3?H2O
B.Ca(OH)2
C.NaOH
濾渣①的主要成分是、、。
(4)向80~90℃的濾液①中分批加入適量KMnO4溶液充分反應后過濾,濾渣②中有MnO2,該步反應的離子方程式為。
(5)濾液②中加入鋅粉的目的是。
(6)濾渣④與濃H2SO4反應可以釋放HF并循環利用,同時得到的副產物是、。組卷:1003引用:9難度:0.6 -
10.氯可形成多種含氧酸鹽,廣泛應用于殺菌、消毒及化工領域。實驗室中利用如圖裝置(部分裝置省略)制備KClO3和NaClO,探究其氧化還原性質。
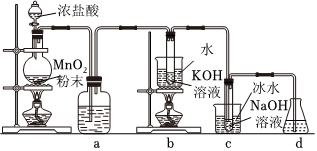
回答下列問題:
(1)盛放MnO2粉末的儀器名稱是,a中的試劑為。
(2)b中采用的加熱方式是,c中化學反應的離子方程式是,采用冰水浴冷卻的目的是。
(3)d的作用是。組卷:10引用:2難度:0.8


