2021-2022學年河南省中原名校聯盟高二(上)第三次適應性聯考化學試卷
發布:2024/4/20 14:35:0
一、單項選擇題:本題共16小題,每小題3分,共48分。
-
1.下列說法正確的是( )
A.水是一次能源,水煤氣是二次能源,天然氣是可再生能源 B.Ba(OH)2?8H2O+2NH4Cl═BaCl2+2NH3+10H2O△H=+80kJ?mol-1能自發進行,原因是體系有自發向混亂度增大的方向轉變的傾向 C.需要加熱才能發生的反應一定是吸熱反應 D.在其他外界條件不變的情況下,使用催化劑,可以改變化學反應進行的方向 組卷:21引用:3難度:0.8 -
2.科學家用X射線激光技術觀察到CO與O在催化劑表面形成化學鍵的過程。其反應過程的示意圖如圖,下列說法正確的是( )
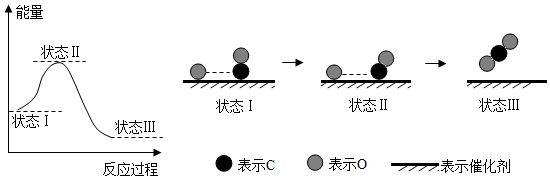
A.CO和O生成CO2是吸熱反應 B.在該過程中,CO斷鍵形成C和O C.CO和O生成了具有非極性共價鍵的CO2 D.狀態Ⅰ→狀態Ⅲ表示CO與O反應的過程 組卷:183引用:7難度:0.4 -
3.下列熱化學方程式或離子方程式中,正確的是( )
A.由熱化學方程式CH3OH(g)+ O2(g)═CO2(g)+2H2(g);△H=-192.9kJ?mol-1,可推知CH3OH(g)的燃燒熱為192.9kJ?mol-112B.已知H2(g)的燃燒熱為285.8kJ?mol-1,則2H2O(l)═2H2(g)+O2(g);△H=+571.6kJ?mol-1 C.HCl(aq)和NaOH(aq)反應的中和熱△H=-57.3kJ?mol-1,則稀H2SO4(aq)和Ba(OH)2(aq)反應生成2mol H2O(l)的反應熱△H=2×(-57.3kJ?mol-1) D.一定條件下,將0.5mol N2和1.5mol H2置于密閉的容器中充分反應生成NH3(g),放熱19.3kJ,其熱化學方程式為N2(g)+3H2(g)?2NH3(g);△H=-38.6kJ?mol-1 組卷:28引用:3難度:0.7 -
4.化學電源在日常生活和高科技領域中都有廣泛應用。
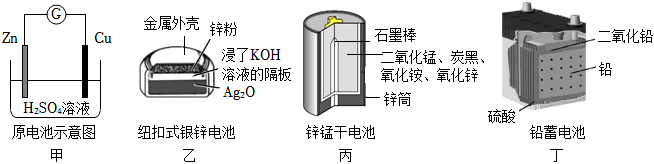
下列說法不正確的是( )A.甲:Zn2+向Cu電極方向移動,Cu電極附近溶液中H+濃度增加 B.乙:正極的電極反應式為Ag2O+2e-+H2O═2Ag+2OH- C.丙:鋅筒作負極,發生氧化反應,鋅筒會變薄 D.丁:使用一段時間后,電解質溶液的酸性減弱,導電能力下降 組卷:1111引用:49難度:0.7 -
5.如圖是某校化學興趣小組設計的一套原電池裝置,下列有關描述正確的是( )

A.此裝置能將電能轉變為化學能 B.石墨電極的反應式:O2+2H2O+4e-═4OH- C.電子由石墨電極經導線流向Cu電極 D.電池的總反應式:2Cu+O2+4HCl═2CuCl2+2H2O 組卷:113引用:5難度:0.8 -
6.驗證犧牲陽極的陰極保護法,實驗如下(燒杯內均為經過酸化的3%NaCl溶液)。下列說法不正確的是( )
① ② ③ 


在Fe表面生成藍色沉淀 試管內無明顯變化 試管內生成藍色沉淀 A.對比②③,可以判定Zn保護了Fe B.對比①②,K3[Fe(CN)6]可能將Fe氧化 C.驗證Zn保護Fe時不能用①的方法 D.將Zn換成Cu,用①的方法可判斷Fe比Cu活潑 組卷:1877引用:32難度:0.8
二、非選擇題(52分)
-
19.化學反應速率與生產、生活密切相關。
(1)A學生為了探究鋅與鹽酸反應過程中的速率變化,他在100mL稀鹽酸中加入足量的鋅粉,用排水集氣法收集反應放出的氫氣,實驗記錄如下(累計值):
①反應速率最大的時間段是時間(min) 1 2 3 4 5 氫氣體積(mL)(標況) 50 120 232 290 310 (填“0~1”“1~2”“2~3”“3~4”“4~5”)min,原因是:。
②反應速率最小的時間段是,原因是:。
③2~3min內該反應的反應速率υ(HCl)=mol?L-1?min-1(設溶液體積不變)。
(2)B學生也做同樣的實驗,但由于反應太快,測不準氫氣體積,故想辦法降低反應速率,請你幫他選擇在鹽酸中加入下列(填字母)以減慢反應速率,同時不影響生成氫氣的量。
A.蒸餾水
B.NaOH溶液
C.Na2CO3溶液
D.CuSO4溶液
E.NaCl溶液
(3)根據化學反應速率理論,聯系化工生產實際,下列說法正確的是(填字母)。
a.化學反應速率理論可指導怎樣在一定時間內快出產品
b.催化劑的使用是提高產品產率的有效方法
c.正確利用化學反應速率可以提高化工生產的綜合經濟效益組卷:5引用:1難度:0.5 -
20.變量控制方法是研究化學變化規律的重要思想方法。請仔細觀察如表中50mL稀鹽酸和1g碳酸鈣反應的實驗數據:
分析上述數據,回答下列問題:實驗序號 碳酸鈣狀態 c(HCl)/(mol?L-1) 溶液溫度/℃ 碳酸鈣消失所用的時間/s 反應前 反應后 1 粒狀 0.5 20 39 400 2 粉末 0.5 20 40 60 3 粒狀 0.6 20 41 280 4 粒狀 0.8 20 40 200 5 粉末 0.8 20 40 30 6 粒狀 1.0 20 40 120 7 粒狀 1.0 30 50 40
(1)該反應屬于反應。(填“吸熱”或“放熱”)
(2)實驗6和7表明,對反應速率有影響,,反應速率越大。
(3)根據實驗1、3、4、6可以得出外界條件對反應速率的影響規律是。
(4)該實驗中影響反應速率的因素還有,能表明這一規律的實驗序號是1和2與。組卷:7引用:2難度:0.7


