2022-2023學年湖南省永州市寧遠一中高二(上)期中化學試卷
發布:2024/11/21 1:0:2
一、單項選擇題:本大題共10小題,每小題3分,共30分。
-
1.下列設備工作時,將化學能轉化為熱能的是( )
A.硅太陽能電池 B.鉛蓄電池 C.燃氣灶 D.電烤箱 組卷:91引用:5難度:0.8 -
2.下列說法中錯誤的是( )
A.2CaCO3(s)+2SO2(g)+O2(g)═2CaSO4(s)+2CO2(g)在低溫下能自發進行,則該反應的△H<0 B.NH4Cl(s)═NH3(g)+HCl(g)室溫下不能自發進行,說明該反應的△H>0 C.若△H<0,△S>0,化學反應在任何溫度下都能自發進行 D.加入合適的催化劑能降低反應活化能,從而改變反應的焓變 組卷:35引用:7難度:0.7 -
3.相同溫度下,關于鹽酸和醋酸兩種溶液的比較,下列說法正確的是( )
A.pH相等的兩溶液中:c(CH3COO-)=c(Cl-) B.分別中和pH相等、體積相等的兩溶液,所需NaOH的物質的量相同 C.相同濃度的兩溶液,分別與金屬鎂反應,反應速率相同 D.相同濃度的兩溶液,分別與NaOH固體反應后呈中性的溶液中(忽略溶液體積變化):c(CH3COO-)=c(Cl-) 組卷:585引用:11難度:0.7 -
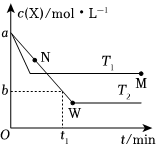 4.在恒容密閉容器中通入X并發生反應:2X(g)?Y(g),溫度T1、T2下X的物質的量濃度c(x)隨時間t變化的曲線如圖所示,下列敘述正確的是( )
4.在恒容密閉容器中通入X并發生反應:2X(g)?Y(g),溫度T1、T2下X的物質的量濃度c(x)隨時間t變化的曲線如圖所示,下列敘述正確的是( )A.該反應進行到M點放出的熱量大于進行到W點放出的熱量 B.T2下,在0~t1時間內,υ(Y)= mol/(L?min)a-bt1C.M點的正反應速率v正大于N點的逆反應速率v逆 D.M點時再加入一定量的X,平衡后X的轉化率減小 組卷:23引用:2難度:0.5 -
5.對于可逆反應:2SO2(g)+O2(g)?2SO3(g),下列措施能使反應物中活化分子百分數、化學反應速率和化學平衡常數都變化的是( )
A.增大壓強 B.升高溫度 C.使用催化劑 D.多充入O2 組卷:415引用:95難度:0.9 -
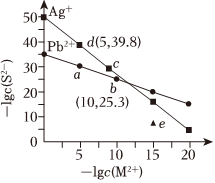 6.工業廢水中含重金屬離子,課通過化學沉淀法將其除去,T℃時,Ag2S與PbS在水中的沉淀溶解平衡曲線如圖所示。(Mn+表示Ag+和Pb2+)下列說法不正確的是( )
6.工業廢水中含重金屬離子,課通過化學沉淀法將其除去,T℃時,Ag2S與PbS在水中的沉淀溶解平衡曲線如圖所示。(Mn+表示Ag+和Pb2+)下列說法不正確的是( )A.e點對應的PbS溶液為過飽和溶液 B.T℃時,Ksp(PbS)=10-35.3 C.向含Ag2S沉淀的懸濁液中加入Na2S固體可實現d點到c點的變化 D.向含0.01mol/L的Ag+、Pb2+的工業廢水通入H2S氣體,首先沉淀的是PbS 組卷:22引用:4難度:0.6
三、非選擇題(本大題共5個小題,共54分)
-
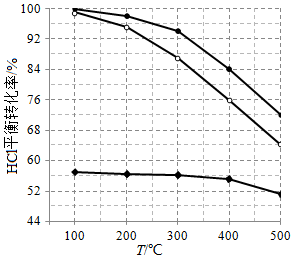 18.近年來,隨著聚酯工業的快速發展,氯氣的需求量和氯化氫的產出量也隨之迅速增長。因此,將氯化氫轉化為氯氣的技術成為科學研究的熱點。回答下列問題:
18.近年來,隨著聚酯工業的快速發展,氯氣的需求量和氯化氫的產出量也隨之迅速增長。因此,將氯化氫轉化為氯氣的技術成為科學研究的熱點。回答下列問題:
(1)Deacon發明的直接氧化法為:4HCl(g)+O2(g)═2Cl2(g)+2H2O(g)。如圖為剛性容器中,進料濃度比c(HCl):c(O2)分別等于1:1、4:1、7:1時HCl平衡轉化率隨溫度變化的關系:可知反應平衡常數K(300℃)K(400℃)(填“大于”或“小于”)。設HCl初始濃度為c0,根據進料濃度比c(HCl):c(O2)=1:1的數據計算K(400℃)=(列出計算式)。按化學計量比進料可以保持反應物高轉化率,同時降低產物分離的能耗。進料濃度比c(HCl):c(O2)過低、過高的不利影響分別是。
(2)Deacon直接氧化法可按下列催化過程進行:
CuCl2(s)═CuCl(s)+Cl2(g) ΔH1=83kJ?mol-112
CuCl(s)+O2(g)═CuO(s)+12Cl2(g) ΔH2=-20kJ?mol-112
CuO(s)+2HCl(g)═CuCl2(s)+H2O(g) ΔH3=-121kJ?mol-1
則4HCl(g)+O2(g)═2Cl2(g)+2H2O(g)的ΔH=kJ?mol-1。
(3)在一定溫度的條件下,進一步提高HCl的轉化率的方法是、。(寫出2種)組卷:32引用:1難度:0.6 -
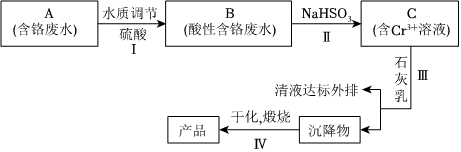 19.某鉻鹽廠凈化含Cr(Ⅵ)廢水并提取Cr2O3的一種工藝流程如圖所示。
19.某鉻鹽廠凈化含Cr(Ⅵ)廢水并提取Cr2O3的一種工藝流程如圖所示。
已知:Ksp[Cr(OH)3]=6.3×10-31
Ksp[Fe(OH)3]=2.8×10-39
Ksp[Fe(OH)2]=4.9×10-17
(1)步驟Ⅰ中,發生的反應為2H++2?Cr2CrO2-4+H2O,B中含鉻元素的離子有O2-7(填離子符號)。
(2)當清液中Cr3+的濃度≤1.5mg?L-1時,可認為已達鉻的排放標準。若測得清液的pH=5,則清液尚不符合鉻的排放標準,因為此時Cr3+的濃度為mg?L-1。
(3)步驟Ⅱ還可用其他物質代替NaHSO3作還原劑。
①若用FeSO4?7H2O作還原劑,反應的離子方程式為,步驟Ⅲ中參加反應的陽離子一定有(填離子符號)。
②若用鐵屑作還原劑,當鐵的投放量相同時,經計算,C溶液的pH與c(Cr2)的對應關系如下表所示:O2-7
有人認為pH=6時,c(Cr2pH 3 4 5 6 c(Cr2 )/mol?L-1O2-77.02×10-21 7.02×10-7 1.25×10-3 2.12×10-34 )變小的原因是Cr2O2-7基本上都已轉化為Cr3+。這種說法是否正確,為什么?O2-7。
③用鐵屑作還原劑時,為使所得產品中含鐵元素雜質的含量盡可能低,需要控制的條件有。組卷:6引用:1難度:0.5


