2023-2024學年江蘇省南通市如皋一中高三(上)開學化學試卷
發布:2024/8/17 2:0:1
一、單項選擇題(本大題共8小題,每題只有1個選項符合題意,每題2分,共16分)
-
1.化學與生活、科技、社會發展息息相關。下列有關說法正確的是( )
A.節日燃放煙花過程中的焰色試驗是化學反應 B.鐵磁流體液態機器人中驅動機器人運動的磁鐵的主要成分是Fe2O3 C.“天問一號”火星車使用熱控保溫材料——納米氣凝膠,可產生丁達爾效應 D.“天和”核心艙電推進系統中使用的氮化硼陶瓷基復合材料屬于新型有機高分子材料 組卷:17引用:6難度:0.5 -
2.NCl3可發生水解反應NCl3+3H2O=NH3+3HClO,下列說法正確的是( )
A.NCl3空間構型為平面三角形 B.H2O分子的空間填充模型為 
C.NH3分子的電子式為 
D.HClO分子的結構式為H-Cl-O 組卷:33引用:1難度:0.8 -
3.侯氏制堿法又稱聯合制堿法,是我國化學工程專家侯德榜于1943年發明的,其主要反應為NaCl+CO2+NH3+H2O=NaHCO3↓+NH4Cl、2NaHCO3
Na2CO3+H2O+CO2↑。土法制燒堿的原理為Na2CO3+Ca(OH)2=2NaOH+CaCO3。下列有關鈉及其化合物的性質與用途具有對應關系的是( )△A.鈉單質熔點較低,可用于冶煉金屬鈦 B.氫氧化鈉具有強堿性,可用作干燥劑 C.碳酸氫鈉受熱易分解,可用于治療胃酸過多 D.碳酸鈉溶液顯堿性,可用于清洗餐具上的油污 組卷:13引用:6難度:0.8 -
4.前四周期主族元素X、Y、Z、W的原子序數依次增大,它們最外層電子數之和為20。常溫下X的單質是一種淡黃綠色氣體,基態Y原子核外有4個能級且均充滿電子,Z的原子共有16種不同運動狀態的電子。下列說法正確的是( )
A.原子半徑:r(X)<r(Y)<r(Z) B.W的第一電離能比同周期相鄰元素的大 C.X的簡單氣態氫化物的熱穩定性比Z的弱 D.Z的最高價氧化物對應水化物的酸性比W的弱 組卷:22引用:1難度:0.7 -
5.在給定條件下,下列選項所示的物質間轉化均能實現的是( )
A.NaCl(aq) Cl2(g)電解FeCl2(s)Fe(s)△B.MgCl2(aq) Mg(OH)2(s)石灰乳MgO (s)煅燒C.S(s) SO3(g)O2(g)點燃H2SO4(aq)H2O(l)D.N2(g) NH3(g)H2(g)高溫高壓、催化劑Na2CO3(s)CO2(g)NaCl(aq)組卷:231引用:33難度:0.5 -
6.如圖為實驗室制備ClO2并驗證其氧化性的實驗裝置,實驗過程中控制甲裝置滴加硫酸溶液的量,其中表述不正確的是( )
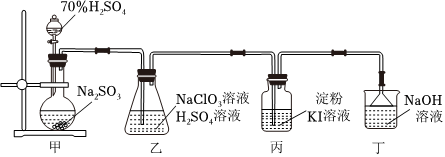
A.用裝置甲產生SO2氣體 B.裝置乙中應通入過量的SO2 C.裝置丙中溶液顏色發生變化,體現了ClO2具有氧化性 D.用裝置丁吸收尾氣 組卷:6引用:3難度:0.7
二、非選擇題(共64分)
-
17.LiFePO4和Li2CO3都是重要的鋰的化合物。
Ⅰ.LiFePO4電極材料是動力型鋰離子電池的理想正極材料。它可以通過H3PO4、LiOH和(NH4)2Fe(SO4)2溶液發生共沉淀反應、將所得沉淀干燥、高溫成型而制得。實驗室制備LiFePO4的方法:
步驟1:將LiOH置于題圖所示實驗裝置的三頸燒瓶中,加入煮沸過的蒸餾水,攪拌使其溶解。從分液漏斗中滴加H3PO4溶液,并持續通入氮氣。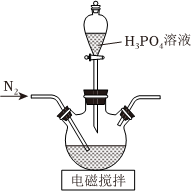
步驟2:將(NH4)2Fe(SO4)2固體溶于蒸餾水中,迅速倒入三頸燒瓶中,快速攪拌,充分反應后,過濾、洗滌濾渣得LiFePO4固體。
(1)共沉淀反應投料時,不將FeSO4和LiOH溶液直接混合的原因是。
(2)工業制取LiFePO4在高溫成型前,常向LiFePO4中加入少量活性炭黑,其作用除了可以改善成型后LiFePO4的導電性能外,還能。
Ⅱ.磷酸鋰渣(主要成分為Li3CO4)和廢舊電極材料(含鋁、炭、LiFePO4和FePO4)均可用于制取Li2CO3。
(3)實驗室以磷酸鋰渣為原料制備高純Li2CO3的部分實驗流程如圖: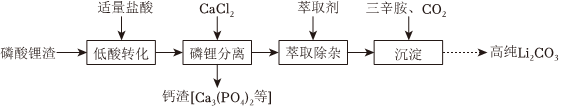
“低酸轉化”使Li3PO4轉化為Li2HPO4。寫出“磷鋰分離”的化學方程式:。
(4)已知:Li2CO3微溶于水;LiFePO4、FePO4難溶于水和堿,可溶于鹽酸生成LiCl、FeCl2、FeCl3和H3PO4;pH>3.2時,Fe3+沉淀完全。完善由某廢舊電極材料制取Li2CO3的實驗方案:邊攪拌邊向廢舊電極材料中加入NaOH溶液至不再產生氣泡,過濾,,過濾、洗滌,低溫干燥得Li2CO3固體。(實驗中須使用的試劑有:雙氧水、鹽酸、NaOH溶液、Na2CO3溶液)組卷:20引用:5難度:0.6 -
18.CuS是一種重要的P型半導體材料。以一種石膏渣[含CaSO4及少量Cu(OH)2、Cu2(OH)2SO4、Zn(OH)2等]為原料制備CuS的實驗流程如圖:
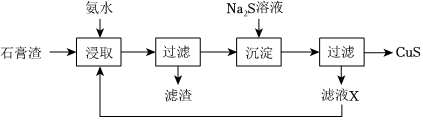
已知:常溫下,Ksp(CuS)=1.27×10-36,Ksp(ZnS)=1.2×10-23。
(1)“浸取”時,生成[Cu(NH3)4]2+與[Zn(NH3)4]2+等。Cu2(OH)2SO4參加反應的離子方程式為。
(2)“沉淀”時Na2S溶液的用量不宜過多,其原因是。
(3)循環“浸取”多次后,“濾液X”中濃度增大的陽離子主要有。
(4)為測定“浸取”時Cu元素浸出率,需先測定石膏渣中Cu元素含量。稱取50.00g石膏渣,加入足量稀H2SO4充分溶解,過濾并洗滌濾渣,將濾液轉移至250mL容量瓶中,加水稀釋至刻度;準確量取25.00mL稀釋后的溶液于錐形瓶中,加入足量KI溶液(2Cu2++4I-=2CuI↓+I2),用0.02000mol?L-1Na2S2O3標準溶液滴定至終點(2S2+I2=S4O2-3+2I-),平行滴定3次,平均消耗Na2S2O3標準溶液23.50mL。計算石膏渣中Cu元素質量分數(寫出計算過程)O2-6。組卷:15引用:5難度:0.6


