2022-2023學(xué)年四川省涼山州安寧河聯(lián)盟高二(下)期末化學(xué)試卷
發(fā)布:2024/6/8 8:0:9
一、選擇題:本題共20小題,每小題2分,共40分。在每小題給出的四個選項中,只有一項是符合題目要求的。
-
1.化學(xué)與生產(chǎn)、生活密切相關(guān),對提高人類生活質(zhì)量和促進社會發(fā)展具有重要作用。下列說法正確的是( )
A.殺滅新冠病毒時所使用的酒精濃度越高滅菌效果越好 B.煤經(jīng)過氣化和液化兩個物理變化,可變?yōu)榍鍧嵞茉?/label> C.疫苗一般應(yīng)冷藏存放,以避免蛋白質(zhì)變性 D.明礬和高鐵酸鉀均可用于水的殺菌、消毒 組卷:4引用:1難度:0.7 -
2.下列物質(zhì)屬于強電解質(zhì)的是( )
A.Al B.CH3COONa C.SO3 D.濃鹽酸 組卷:65引用:1難度:0.8 -
3.下列化學(xué)用語或圖示表述表示不正確的是( )
A.硝基苯的結(jié)構(gòu)簡式: 
B.質(zhì)量數(shù)為2的氫核素: H21C.H2O2的電子式為: 
D.氯離子的結(jié)構(gòu)示意圖:  組卷:13引用:1難度:0.7
組卷:13引用:1難度:0.7 -
4.NA為阿伏加德羅常數(shù)的值,下列說法正確的是( )
A.室溫下,pH=9的Na2CO3溶液中由水電離出的OH-數(shù)目為10-5NA B.標準狀況下,22.4LCCl4含有NA個CCl4分子 C.電解精煉銅時,當(dāng)陰極生成32g銅,轉(zhuǎn)移電子數(shù)一定為NA D.將0.1molH2和0.1molI2于密閉容器中充分反應(yīng)后,HI分子總數(shù)為0.2NA 組卷:44引用:1難度:0.6 -
5.可逆反應(yīng)A(g)+B(g)?2C(g)+D(g)進行過程中的能量變化如圖所示,下列敘述正確的是( )
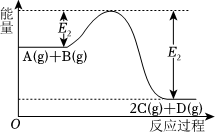
A.該反應(yīng)的焓變ΔH>0,熵變ΔS<0 B.增加壓強,平衡常數(shù)將減小 C.由ΔG=ΔH-TΔS可知,該反應(yīng)能自發(fā)進行 D.恒容密閉容器內(nèi)混合氣體的密度不再變化,說明該反應(yīng)達到平衡狀態(tài) 組卷:72引用:1難度:0.7 -
6.NaOH標準溶液的配制和標定,需經(jīng)過NaOH溶液配制、基準物質(zhì)H2C2O4?2H2O的稱量以及用NaOH溶液滴定等操作。下列有關(guān)說法正確的是( )
A. 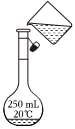
用圖所示操作轉(zhuǎn)移NaOH溶液到容量瓶中B. 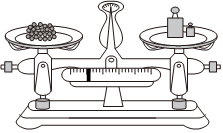
用圖所示裝置準確稱得0.1575gH2C2O4?2H2O固體C. 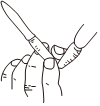 用
用
圖所示操作排除堿式滴定管中的氣泡D. 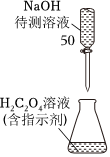
用圖所示裝置以NaOH待測液滴定H2C2O4溶液組卷:74引用:19難度:0.9 -
7.下列實驗操作、現(xiàn)象及所得結(jié)論均正確的是( )
實驗操作 實驗操作 現(xiàn)象 結(jié)論 A 將水加入到下列裝置中 
U形管內(nèi)的紅墨水液面左低右高 Na2O2與水的反應(yīng)為放熱反應(yīng) B 將足量的SO2通入酸性高錳酸鉀溶液 溶液的紫色褪去 SO2具有漂白性 C 將紅熱的鉑絲伸入如圖所示的錐形瓶中 
瓶口出現(xiàn)少量紅棕色氣體 氨的氧化產(chǎn)物為NO2 D 向乙醇中加入一小粒金屬鈉 產(chǎn)生無色氣體 乙醇中含有水 A.A B.B C.C D.D 組卷:6引用:1難度:0.5 -
8.下列說法不正確的是( )
A.乙酸乙酯等酯類物質(zhì)可用作食品添加劑 B.利用糧食釀酒經(jīng)歷了淀粉→葡萄糖→乙醇的化學(xué)變化過程 C.蠶絲、淀粉、合成纖維、高吸水性樹脂等都屬于高分子材料 D.糖類、油脂、蛋白質(zhì)在一定條件下都能發(fā)生水解反應(yīng) 組卷:30引用:1難度:0.8
二、非選擇題:本題共6小題,共60分。
-
25.有效去除大氣中的H2S、SO2以及廢水中的硫化物是環(huán)境保護的重要課題。
(1)H2S與CO2在高溫下發(fā)生反應(yīng):H2S(g)+CO2(g)?COS(g)+H2O(g)。在610K時,將0.40molH2S與0.20molCO2充入5L的鋼瓶中,反應(yīng)達到平衡后水的物質(zhì)的量分數(shù)為0.2。
①上述條件下H2S的平衡轉(zhuǎn)化率α1=。
②若在620K重復(fù)實驗,平衡后水的物質(zhì)的量分數(shù)為0.3,該反應(yīng)的ΔH0(填“<”“>”或“=”)。
③在610K時反應(yīng)H2S(g)+CO2(g)?COS(g)+H2O(g)平衡建立的基礎(chǔ)上,改變下列一種條件,能使H2S平衡轉(zhuǎn)化率增大的是(填標號)。
A.向容器中通入H2S
B.向容器中通入CO2
C.加入催化劑
D.縮小容器的體積
(2)在氣體總壓強分別為p1和p2時,反應(yīng)2SO3(g)?2SO2(g)+O2(g)在不同溫度下達到平衡,測得SO3(g)及SO2(g)的物質(zhì)的量分數(shù)如圖所示:
①壓強:p2p1(填“>”或“<”),判斷的理由是。
②若p1=8.1MPa,起始時充入amol的SO3(g)發(fā)生反應(yīng),計算Q點對應(yīng)溫度下該反應(yīng)的平衡常數(shù)Kp=MPa(用平衡分壓代替平衡濃度計算,分壓=總壓×物質(zhì)的量分數(shù))。組卷:41引用:1難度:0.6 -
26.FeCl3是飲用水、工業(yè)用水、城市污水及游泳池循環(huán)水處理的高效廉價絮凝劑,也是中學(xué)實驗室中常見的試劑。某實驗小組用以下裝置制備FeCl3固體,并探究FeCl3溶液與Cu的反應(yīng)。
已知:FeCl3晶體易升華,F(xiàn)eCl3易水解。
Ⅰ.FeCl3的制備
(1)裝置C中堿石灰的作用是。
(2)從D、E、F中選擇合適的裝置制備純凈的Cl2,正確的接口順序為a→(可選試劑:飽和食鹽水、NaOH溶液、濃硫酸、堿石灰,儀器可以重復(fù)使用)。
(3)寫出裝置D中制備Cl2的離子方程式:。
Ⅱ.探究FeCl3溶液與Cu的反應(yīng)
向4mL0.1mol/LFeCl3溶液中滴加幾滴0.2mol/LKSCN溶液,溶液變紅;再加入過量Cu粉,溶液紅色褪去,不久有白色沉淀產(chǎn)生。
查閱資料可知:CuCl和CuSCN均為難溶于水的白色固體。針對白色沉淀同學(xué)們有以下猜想:
猜想1:Cu2+與過量的Cu粉反應(yīng)生成Cu+,再結(jié)合Cl-生成白色沉淀CuCl。
猜想2:Cu2+與SCN-發(fā)生氧化還原反應(yīng)生成Cu+,再結(jié)合SCN-生成白色沉淀CuSCN。
針對上述猜想,實驗小組同學(xué)設(shè)計了以下實驗:
(4)實驗結(jié)果說明猜想實驗編號 操作 現(xiàn)象 實驗1 
加入銅粉后無現(xiàn)象 實驗2 
溶液很快由藍色變?yōu)榫G色,未觀察到白色沉淀;2h后溶液為綠色,未觀察到白色沉淀;24h后,溶液綠色變淺,試管底部有白色沉淀 (填“1”或“2”)不合理。
(5)根據(jù)實驗現(xiàn)象進一步查閱資料發(fā)現(xiàn):
i.Cu2+與SCN可發(fā)生如下兩種反應(yīng):
反應(yīng)A:Cu2++4SCN-=[Cu(SCN)4]2-(淡黃色)
反應(yīng)B:2Cu2++4SCN-=2CuSCN↓+(SCN)2(黃色)。
ii.[Cu(SCN)4]2-與Cu2+共存時溶液顯綠色。
①由實驗2中的現(xiàn)象推測,反應(yīng)速率:A(填“>”或“<”)B,說明反應(yīng)B(填“是”或“不是”)產(chǎn)生CuSCN的主要原因。
②進一步查閱資料可知,當(dāng)反應(yīng)體系中同時存在Fe2+、Cu2+、SCN時,Cu2+氧化性增強,可將Fe2+氧化為Fe3+。據(jù)此將實驗2改進,向CuSO4溶液中同時加入KSCN、FeCl2,立即生成白色沉淀CuSCN,寫出該反應(yīng)離子方程式:。組卷:21引用:1難度:0.6


